Изотермическая выдержка
 23 апреля, 2013
23 апреля, 2013  admin
admin Если на какой-либо стадии пиролиза мгновенно прекратить подъем температуры и термостатировать реакционную смесь, система немедленно начнет переход в новое, термодинамически определенное равновесное состояние, качественно отличное от предшествовавшего неравновесного состояния. В то же время стабилизация температуры не означает прекращения энергетического обмена системы со средой. Если, например, при данном состоянии системы в ней преобладают эндотермические реакции, то для поддержания температуры на постоянном уровне необходимо непрерывно сообщать системе соответствующее количество тепла. Поэтому мгновенная стабилизация температуры отнюдь не приводит к столь же быстрому прекращению химических реакций, начавшихся или подготовленных предыдущей стадией. Как показывает опыт, эти реакции продолжаются еще довольно длительное время и вполне прекращаются лишь спустя 3—4 ч после начала выдерживания.
Этот сложный процесс находит свое отражение в изменении теплоемкости твердого остатка пиролиза. Однако, переходя к рассмотрению теплоемкости, необходимо прежде уточнить, что в данном случае подразумевается под этим понятием. Дело в том, что теплоемкость, в принципе, не может быть определена в изотермических условиях. Поэтому образец, подвергнутый в ходе исследования изотермическому выдерживанию при температуре Тв, может быть испытан только при температуре 7'н<Гв. Ясно, что в этих условиях речь должна идти о некоторой «квазиравновесной»[4] теплоемкости, определяющейся физическим состоянием испытуемого материала.
На рис. 45 показано изменение теплоемкости бурого и газового углей (см. табл. VII. 9), подвергнутых изотермическому выдерживанию при температуре 300 и 700° С, т. е. углей соответственно на эндо - и экзотермической стадиях пирогенного процесса [68]. Во всех случаях сразу после начала термоста-
|
А Ср, ккал/(кг°С) |
|
0,46 |
|
0,25 I I I |
|
'*—1_ I_ I_ I_ I_ и и—I—I— 1, 0 10 20 30 120 240 Выдержка, мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()

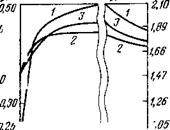
Рис. 45. Изменение теплоемкости твердых остатков пиролиза в ходе изотермической выдержки при 300 (а) и 700° С (б):
1 — бурый уголь Ирша-Бородинского месторождения; 2—газовый уголь ш. «Полы - саевская-2»); 3— газовый уголь ш. «Комсомолец*
Тирования теплоемкость твердого остатка заметно возрастает (см. рис. 45), а достигнув через некоторое время максимума, она снижается, асимптотически стремясь к величине, характерной для истинной (равновесной) теплоемкости. При этом нисходящая ветвь зависимости С(т) хорошо подчиняется логарифмическому закону. Аналогичное поведение теплоемкости при изотермическом выдерживании наблюдали также В. И. Ка - саточкин с сотрудниками [86] и другие исследователи.
Из уравнения Аррениуса следует, что при постоянной температуре наибольшей скоростью характеризуются реакции с малой энергией активации. К числу таковых относятся в первую очередь реакции ассоциации. Скорость же протекающих параллельно реакций деструкции в этих условиях значительно ниже. Этим, по-видимому, объясняется появление максимумов на кинетических кривых теплоемкости.
В табл. VIII.11 и VIII.12 приведены результаты определения теплоемкости некоторых углей в процессе изотермической выдержки при 300 и 700° С.

 Опубликовано в
Опубликовано в