ИСТОЧНИКИ АРЕНОВ
 30 июля, 2013
30 июля, 2013  admin
admin Основные источники сырья для производства аренов - нефть и каменный уголь. Важнейшие процессы получения аренов из нефтяного сырья - каталитический риформинг бензиновых фракций и пиролиз углеводородного сырья (бензиновой и более высококипящих фракций, а также низкокипящих алканов). Арены образуются также при коксовании каменного угля.
Сравнительно небольшие количества аренов производятся ароматизацией низкомолекулярных алканов, термической переработкой горючих сланцев. Проходят опытно-промышленные испытания процессы ожижения углей. Арены получаются также при вакуумном пиролизе резиновых шин, при деполимеризации полимеров, в частности полистирола. Проводятся исследования по получению аренов из природного газа и метанола.
Значительные количества аренов производятся с помощью их взаимных превращений: гидродеалкилированием (толуола, гомологов нафталина), диспропорционированием, трансалкили - рованием, изомеризацией.
Выбор сырья для производства аренов различается в разных странах и регионах мира. Так, в США в 1981 г. структура производства бензола была следующей, %: каталитический риформинг - 48, гидродеалкилирование - 29, выделение из продуктов пиролиза - 19, выделение из продуктов коксования каменного угля - 4 [19]. В России, на Ближнем Востоке основной процесс производства бензола, толуола, ксилолов - также каталитический риформинг. В Западной Европе наряду с каталитическим риформингом важнейшим источником аренов является пиролиз углеводородного сырья.
Производство бензола, толуола и ксилолов в России размещено на 15 нефтеперерабатывающих предприятиях, в том числе на 10 из них - на основе процесса каталитического риформинга, на трех - выделением из продуктов пиролиза и на двух заводах (Ангарская НХК и АО «НОРСИ») - на базе как каталитического риформинга, так и пиролиза. Общие мощности производства аренов С6-С8 на нефтеперерабатывающих заводах России составляют 2.2 млн. т/год, однако средний объем выработки аренов в 1998 г. не превышал 40 % от их возможного объема производства [20].
Анализ стоимости переработки сырья, содержащего арены, проведен в работах [21, 22].
Технико-экономические показатели производства аренов различными методами сопоставлены в табл. 1 [21]. Приведены расходные показатели на 1 т аренов при их производстве с использованием процессов каталитического риформинга различных бензиновых фракций с последующей экстракцией; выделением аренов С8 из фракции катализата риформинга простой ректификацией без экстракции; процесса «Пиротол» фирмы «Houdry Process and Chemical Co.», предназначенного для получения бензола из жидких продуктов пиролиза гидродеалкилированием с предварительной гидроочисткой; экстракцией аренов из пироконденсата; гидродеалкилированием толуола; диспропорционированием толуола с получением бензола и ксилолов; трансалкилированием толуола и аренов С9.
|
ТАБЛИЦА 1 Технико-экономические показатели производства аренов
|
Технология процесса каталитического риформинга бензиновых фракций широко освещена в ряде монографий [4, 11—13]. Механизмы реакций ароматизации углеводородов рассмотрены в монографии [23]. Моделированием процесса каталитического риформинга достигнута хорошая согласованность расчетных и экспериментальных данных [24, 25].
За рубежом широко применяется процесс каталитического риформинга с непрерывной регенерацией катализатора типа И-134 [26] или СИ 401 [27]. Это позволяет снизить давление в реакторах до 0.7 МПа и повысить выход аренов на 48 %, а при давлении 0.5 МПа - на 65 % [28]. В последние годы за рубежом вводятся в промышленную эксплуатацию преимущественно установки каталитического риформинга еще более низкого давления (0.35 МПа) с непрерывной регенерацией катализатора, комбинированные с процессами изомеризации легкого бензина и удаления бензола [20].
Процессы пиролиза углеводородного сырья и переработки получающихся жидких продуктов рассмотрены в монографии
[14] . При пиролизе прямогонного бензина на 1 т этилена получается около 1 т жидких продуктов, которые разделяют ректификацией на пироконденсат, или легкую смолу пиролиза (фракция 28-200 °С) и тяжелую смолу пиролиза (выше 200 °С). Ресурсы жидких продуктов пиролиза к 1995 г. оценивались в 60 млн. т. Из этого количества жидких продуктов пиролиза можно получать до 40 % мирового производства бензола по себестоимости на 35-40 % ниже по сравнению с экстракцией из катализатов риформинга [29]. Промышленное производство бензола из пироконденсата каталитическим гидродеалкилированием описано в обзоре [30].
Фракция С8 пироконденсата служит сырьем для выделения стирола [31] и ксилолов [32].
Фракция 200-260 °С тяжелой смолы пиролиза содержит около 58 % (мае.) нафталина и метилнафталинов, в том числе, % (мае.): нафталина - 27.0, 2-метилнафталина - 17.7, 1-метилнафталина -
13.4 [33]. Разработаны процессы производства нафталина из тяжелой смолы пиролиза [29, 34].
Тяжелая смола пиролиза содержит также различные полициклоарены и является сырьем для производства технического углерода, нефтеполимерных смол. Во ВНИИОС разработан процесс получения на основе тяжелой смолы пиролиза суперпластификатора бетонов сульфированием при 160 °С с последующей нейтрализацией сульфокислот 55 % - м раствором КаОН при 80 °С [29].
Компанией «Mobil Oil» разработан процесс производства бензола, толуола и ксилолов из нафты. Прямогонную фракцию 149-260 °С подвергают гидроочистке на цеолите типа ZSM-5 или цеолите Р, а затем каталитическому крекингу в присутствии кислотных катализаторов при 340-454 °С, давлении 0.35-10.5 МПа и расходе водорода до 500 м'3/м3 сырья. Арены С6-С8 экстрагируют из продуктов каталитического крекинга [35].
Ароматизация легкого газойля селективно протекает при температуре около 540 °С на цеолитах типа ZSM-5, ZSM-11 и SABO-11 (типа бороалюмосиликата) в Zn-формах [36].
Ароматизация низкомолекулярных алканов и алкенов С2-С5 на цеолитных катализаторах рассмотрена в обзорах [37-41].
В 1980-е годы разработана фирмами «British Petroleum» и «UOP» технология процесса «Cyclar» производства бензола, толуола и ксилолов ароматизацией пропана и бутана. В 1989 г. процесс реализован на промышленной установке в Грейнжмуте, Шотландия [42,43]. Однако широкого распространения процесс «Cyclar» в промышленности не получил, по-видимому, из-за высоких эксплуатационных затрат. Суммарный выход аренов - бензола, толуола и ксилолов - в соотношении около 1:2:1 достигает 63.7 % [44].
Японская фирма «Сапуо Petrochemical Со.» реализовала в промышленности процесс «Alpha» - конверсии легких алкенов С4-С6 в бензол - толуол - ксилолы. Процесс осуществляется при 400-520 °С и давлении 0.3-0.6 МПа на цеолитном катализаторе ZSM-5, модифицированном неблагородными металлами. Установка суммарной производительностью 556.4 м3/сут аренов С6-С8 действует в г. Мицусима. В процессе используются два качающихся реактора с неподвижным слоем катализатора, один из которых работает, а другой находится на регенерации. Реакция циклизации алкенов - экзотермическая, поэтому процесс отличается низкими удельными энергозатратами. В качестве сырья перерабатываются легкие фракции, являющиеся побочными продуктами крекинга тяжелого бензина [45, 46].
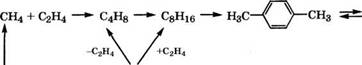
Схема механизма ароматизации низкомолекулярных алканов на цеолитах рассмотрена в работах [47-50]. Установлено, что сначала протекают дегидрирование и крекинг алканов с образованием алкенов, которые олигомеризуются, затем осуществляется дегидроциклизация и дегидрирование циклооле - финов. При этом бензол, толуол и /г-ксилол образуются в результате прямой ароматизации, например, пропана, а другие изомеры ксилола и высшие арены получаются при вторичных реакциях [48]:
|
|
|
С3Н8 С3Нб ► СеНхг СбНе |
|
-н2 |
|
1 |
+н2 +с3н6
![]()
|
СН4 + С2Н6 СдН^з ----- ^ С7Н14 ► С6Н5СН3 |
![]()
|
СН3 |
![]()
|
Н3С |
![]()
|
СН3 |
![]() ▼ - С2н4
▼ - С2н4
2С6Н4(СН3)2 ^ С6Н6 + С6Н3(СН3)3
2С6Н5СН3 ^ С6Н6 + С6Н4(СН3)2
Алкилирование
|
Низшие арены |
![]()
|
Деалкилирование |
![]() Высшие арены
Высшие арены
Кинетическая модель ароматизации этилена и пропилена на цеолитах Н^ЙМ-б и Са/Н-ЕБМ-б изучена в работе [51]. Сопоставлены константы скоростей различных стадий: олигомеризация алкенов - более медленная стадия, чем их крекинг; образование диенов за счет переноса водорода и дегидрирования происходит в 10-100 раз медленнее, чем олигомеризация; циклизация диенов протекает с такими же константами скоростей, как и крекинг алкенов; образование циклоалкадиенов - со скоростью, аналогичной олигомеризации алкенов; образование аренов - более быстрая стадия, чем олигомеризация алкенов.
При промотировании цеолитов семейства пентасила галлием селективность образования аренов повышается в 2-2.5 раза. Глубина и селективность превращения алканов С2-С5 определяется составом катализатора, способом введения Оа в цеолит, концентрацией промотора, условиями предварительной активации каталитических систем и особенностями их кислотных свойств. Так, при ароматизации пропана при 550 °С на пентасиле без Оа селективность образования аренов 32.3 %, а при введении 1.5 % (мае.) Оа она возрастает до 54.8 % [40].
|
9 |
![]() Селективность образования^аренов из алкенов выше, чем из алканов с тем же числом углеродных атомов. Так, при 500 °С на высококремнеземном Оа-содержащем цеолите с мольным отно-
Селективность образования^аренов из алкенов выше, чем из алканов с тем же числом углеродных атомов. Так, при 500 °С на высококремнеземном Оа-содержащем цеолите с мольным отно-
2- 12 Л-4
Шением 8Ю2/А1203 = 70 селективность по аренам при ароматизации пропана составила 54.2 %, а из пропилена — 74.6 % [52].
При использовании цеолита Н^8М-5, модифицированного пропиткой Оа, затем ионным обменом с замещением 66 % на Си, ароматизация бутана происходит с конверсией 80 % при 550 °С и селективностью по аренам более 60 %. Еще более активен цеолит, модифицированный пропиткой однако селективность образования аренов снижается при этом до 50 % [41].
По влиянию на каталитическую активность цеолитов в реакции ароматизации изобутана металлы располагаются в ряд:
Ъп > Оа > № > Со > Ыё > Си
Наилучшие результаты при ароматизации изобутана (конверсия 100%, выход жидких продуктов 40.5%) получены на пентасиле, модифицированном 2 % Zn, при 550 °С и объемной скорости подачи сырья 518 ч”1 [53].
По реакционной способности в присутствии пента* силсодержащих катализаторов, модифицированных 2 % (мае.) Zn2 углеводороды располагаются в ряд [54]:
^2-^-4 ^ с3н6 > ;-с4н10 > Н-С4н10 > с3н8
Проведение ароматизации углеводородов С2-С3 в присутствии интерметаллида Zr2Fe, являющегося акцептором выделяющегося водорода, подавляет образование СН4, позволяет снизить температуру процесса до 450-550 °С и повысить селективность и выход аренов [55].
Выход аренов С6-С8 при ароматизации пропана на цеолитсодержащих катализаторах составляет обычно 48-51 %, при ароматизации бутанов - 52-54 %. Алканы С5 и более высокомолекулярные ароматизируются полностью, однако из-за усиленного коксообразования и снижения продолжительности межрегене - рационного пробега катализатора рекомендуется предварительно отделять фракцию С5. Реакционный цикл продолжается 270-350 ч, длительность регенерации - 80 ч, общий срок службы катализатора - не менее 1 года [56]. Предполагается, что дезактивация катализатора происходит в результате образования кокса из промежуточных алкенов, а не из образовавшихся аренов [57].
Проводятся также исследования ароматизации метана [58- 63]. Так, в Оксфордском университете разработан способ конверсии метана в бензол, при которой смесь СН4 и 02 в объемном соотношении (6-20) : 1 взаимодействует в трубчатом реакторе из 8Ю2 при 950 °С в присутствии катализаторов №/А1203, Р1/А1203, К/ВаС03, оксида Бт, М£0 или МаО/М^О. Селек - 10 тивность образования бензола возрастает при повышении давления, и при Р = 0.6 МПа составляет 18.5 %, а при увеличении температуры до 1000 °С достигает 32 % [64]. В качестве достаточно активного и селективного катализатора проявил себя Мо2С7 на цеолите ZSM-5. Однако недостатками процесса являются высокая температура - 700-750 °С и низкая конверсия метана - 6-7 % при селективности образования бензола 80-85 % [60]. Дополнительное модифицирование катализатора европием повышает его активность: ароматизация метана на Еи-Мо/Н- гйМ-б при 750 °С происходит при конверсии 19 % с селективностью по бензолу 98 %, однако при этом усиливается и зауглеро - живание катализатора [62].
Дегидроароматизация метана в присутствии добавок СО или С02, которые ингибируют поликонденсацию аренов, протекает с меньшим зауглероживанием катализатора. Так, при использовании катализатора 3 % (мае.) Мо/Н^8М-5, модифицированного кобальтом, при 700 °С достигается следующая селективность образования аренов, %: бензол - 68.6, нафталин - 26.6, толуол - 3.47, 2-метилнафталин - 0.73. Конверсия метана составляет 10-13 % [65].
Таким образом, ароматизацию природного газа можно рассматривать как перспективное направление производства аренов, прежде всего бензола.
Разрабатываются процессы получения аренов С6-С8 конверсией метанола или этанола на высокоселективных цеолитных катализаторах. Так, при использовании этанола в качестве сырья при 450 °С содержание бензола, толуола и ксилолов в продуктах составляет 33 % (мае.). Процесс протекает через промежуточную дегидратацию этанола в этилен [66].
Конверсией метанола на цеолитах типа ультрасила с мольным соотношением 8Ю2/А1203 = 61, модифицированного лантаном и фосфором, возможно селективное получение п-ксилола. Так, при содержании Ьа 5 % (мае.) суммарный выход ксилолов составляет 18 % при селективности по п-ксилолу 72 %. Дополнительное введение в состав Ьа-ультрасила до 2 % (мае.) фосфора повышает пара-селективность до 92 % при незначительном 'снижении активности катализатора [67].
При коксовании каменного угля помимо кокса образуются «сырой бензол» и каменноугольная смола. «Сырой бензол» служит важным источником аренов С6-С9, так как в его состав входят, % (мае.): бензол 65-75, арены С7-С9 22-18, непредельные соединения 8.4-6.1, серо - и азотсодержащие соединения 1.9-0.5, насыщенные углеводороды 1.1-0.5. Так, по данным УХИНа «сырой бензол», получаемый на коксохимических заводах Ук-
|
Предельные коэффициенты активности углеводородов, селективность экстрагентов по отношению к системам гексан - бензол (Уг /Тб) и циклогексан - бензол [у°цг/у°6), селективность по молекулярным массам [(І£ Уокт/Угп)1 и растворяющая способность экстрагентов (1/уб)
|
|
N-Метилпиррол идон |
30 60 |
14.2 9.9 |
17.7 11.5 |
21.6 13.1 |
8.52 6.30 |
1.08 1.08 |
[75] [85] |
13.1 9.17 |
7.89 5.83 |
0.086 0.057 |
0.926 0.926 |
|
Ы-Метилкапролактам |
20 40 60 |
6.8 6.0 5.4 |
7.9 6.8 5.8 |
9.1 7.1 6.7 |
4.2 4.0 3.3 |
0.85 0.85 0.87 |
|[85] |
8.0 7.1 6.2 |
4.9 4.7 3.8 |
0.061 0.019 0.063 |
1.176 1.176 1.149 |
|
Диметилформамид |
25 40 |
17.6 14.7 |
22.7 18.9 |
29.4 24.2 |
11.6 9.9 |
1.47 1.43 |
}[85] |
12.0 10.3 |
7.89 6.92 |
0.112 0.107 |
0.680 0.699 |
|
1Ч-Метилморфолинон-3 |
30 |
39.4 |
55.7 |
80.4 |
21.9 |
2.20 |
[86,87] |
17.9 |
9.95 |
0.159 |
0.455 |
|
N-Ацетилоксазо лидин |
30 |
32.7 |
40.6 |
52.6 |
17.6 |
1.84 |
[87,88] |
17.8 |
9.57 |
0.089 |
0.543 |
|
М-Метилоксазолидинон-2 |
30 |
39.7 |
53.1 |
70.4 |
21.2 |
1.98 |
[87,88] |
20.1 |
10.7 |
0.123 |
0.505 |
|
ТиетДн-1-оксид |
30 |
44.6 |
59.6 |
79.0 |
21.2 |
1.97 |
[87,89] |
22.6 |
10.8 |
0.122 |
0.508 |
|
Тиофан-1-оксид |
30 |
28.0 |
38.2 |
53.1 |
14.6 |
1.64 |
[87,89] |
17.1 |
8.9 |
0.143 |
0.610 |
|
2-Метилтиетан-1,1 - |
30 |
33.3 |
44.2 |
58.8 |
18.1 |
1.90 |
[90] |
17.5 |
9^3 |
0.124 |
0.526 |
|
Диоксид |
|||||||||||
|
2-Тетрагидрофурфурил- |
30 |
12.1 |
15.6 |
19.6 |
7.10 |
1.17 |
[91] |
10.4 |
6.07 |
0.099 |
0.855 |
|
Оксипропионитрил |
|||||||||||
|
Цианэтильные Производные |
30 40 |
54.5 44.6 |
77.0 62.8 |
109 88.2 |
24.5 20.8 |
2.26 2.12 |
[92] |
24.1 21.0 |
10.8 9.81 |
0.151 0.147 |
0.442 0.472 |
|
Метилиденглицеринов |
|||||||||||
|
Левулинонитрил |
30 |
44.6 |
63.0 |
90.0 |
24.0 |
2.43 |
[93] |
18.4 |
9.88 |
0.155 |
0.412 |
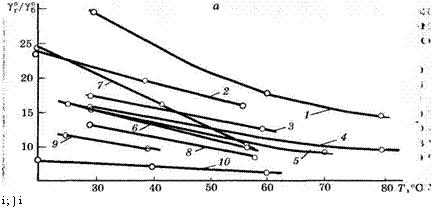
По селективности по отношению к системе гексан - бензол при 60 °С экстрагенты располагаются в следующий ряд: сульфолан > диметилсульфоксид > К-формилморфолин > ТЭГ « тетраэтиленгликоль ~ ДЭГ ~ ЭГ > ]М-метилпирролидон > диметилформамид > ]^-метилкапролактам.
|
І; ) і |
|
Рис. 1. Зависимость селективности растворителей по отношению к системам гексан — бензол (а) и циклогексан — бензол (б) от температуры: 1 - сульфолан; 2 - диметилсульфоксид; 3 - М-формилморфолин; 4 - ТЭГ; 5 - тетраэтиленгликоль; 6 - ДЭГ; 7 - этиленгликоль; 8 - ЇЧ-метилпирролидон; 9 - диметилформамид; 10 - ЇЧ-метилкапролактам |
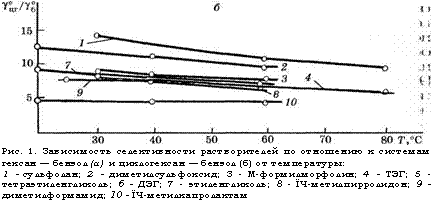 Практически в той же последовательности располагаются экстрагенты и по селективности к системе циклогексан - бензол, только в этом случае Ы-метилпирролидон и диметилформамид оказываются близки к гликолям.
Практически в той же последовательности располагаются экстрагенты и по селективности к системе циклогексан - бензол, только в этом случае Ы-метилпирролидон и диметилформамид оказываются близки к гликолям.
По растворяющей способности к аренам при одинаковой температуре экстрагенты располагаются в следующий ряд: ]М-метил-
Капролактам > N-метилпирролидон > диметилформамид > Ы-фор - милморфолин > сульфолан ~ тетраэтиленгликоль > диметилсуль - фоксид > ТЭГ > ДЭГ > этиленгликоль.
Низкая растворяющая способность характерна для сильно ассоциированных растворителей - гликолей, диметилсульфок - сида. Эти же растворители проявляют и повышенную селективность по молекулярным массам, что обусловлено высокими значениями удельных энтальпий образования полости в структуре ассоциированных экстрагентов и быстро возрастающими затратами энергии при растворении углеводородов-гомологов с увеличением их молярных объемов.
В табл. 2 представлены также данные о селективности и растворяющей способности ряда растворителей, предложенных для экстракции аренов в результате многолетних исследований, проводимых в Санкт-Петербургском государственном технологическом институте [16]. По сочетанию высокой групповой селективности и растворяющей способности, умеренной селективности по молекулярным массам эти растворители не уступают наиболее эффективным промышленным экстрагентам - сульфолану и >»[-фор- милморфолину. Высокая эффективность Ы-метилморфолинона-З [94], ]У-ацетилоксазолидина [95], N-метилоксазолидинона-2 [96], тиетан-1-оксида и тиофан-1-оксида [97], 2-метилтиетан-1,1-диок - сида [98], цианэтильных производных метилиденглицеринов (продуктов конденсации глицерина с формальдегидом) [99], левули - нонитрила [100] подтверждена и результатами экстракции аренов из модельных смесей с насыщенными углеводородами и из фракций катализата риформинга.
2-Тетрагидрофурфурилоксипропионитрил - продукт циан - этилирования тетрагидрофурфурилового спирта - проявляет высокую растворяющую способность по отношению к аренам и, подобно N-метилпирролидону и >«[-метилкапролактаму, в смесях с этиленгликолем или водой также может эффективно экстрагировать арены из катализатов риформинга [101, 102].
Высокая селективность предложенных растворителей обусловлена наличием в их молекулах высокополярных электроноакцепторных групп и гетероатомов, приводящих к неравномерному распределению зарядов и высокой электроноакцепторной способности растворителей при образовании тг-комплексов с аренами.
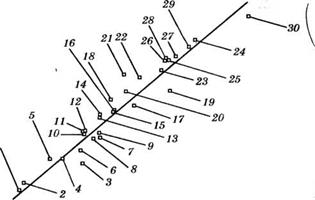
Между селективностью 30 органических растворителей различных классов по отношению к системе гексан - бензол при 30 °С и критерием (Ед/)/!^, использованным в качестве характеристики силового поля молекул растворителей, установлена удовлетворительная корреляция (рис. 2) [103,104]. Нумерация растворителей
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|
|
|||
|
|
|
|||
|
|
Рис. 2. Зависимость селективности растворителей по отношению к системе гексан — бензол от неравномерности распределения зарядов в молекулах растворителей
На рис. 2 соответствует нумерации в табл. 3, в которой приведены селективности растворителей, суммы положительных зарядов атомов Е<7/, рассчитанных при полной оптимизации геометрии молекул с использованием метода МКБО в приближении КББО, молярные объемы У1 и критерии (Ед/)/^. Отмеченная линейная зависимость описывается уравнением:
(Уг / Уб) = 0.1917 + 90.28 • Ю^д^/У,.
С коэффициентом корреляции г = 0.959.
При включении в корреляцию данных для наиболее селективного растворителя - воды коэффициент корреляции возрастает до 0.970.
Корреляции селективности растворителей с величинами максимальных положительных (<7мах) или отрицательных зарядов атомов (</мах) или этих значений, отнесенных к молярным объемам У1У практически не выполняются (г — 0.635-0.736).
Как следует из табл. 3, N-ацетилоксазолидин, 1чГ-метилморфо - линон-3 и тиофан-1-оксид, как и наиболее селективные промышленные экстрагенты (сульфолан, диметилсульфоксид, N-форми л мор - фол ин), относятся к группе растворителей с наиболее неравномерно распределенными зарядами. Таким образом, установлена достаточно универсальная зависимость селективности от расчетной
|
Селективность растворителей по отношению к системе гексан - бензол при 30 °С и молекулярная плотность зарядов
|
Величины силового поля молекул, позволяющая прогнозировать групповую селективность экстрагентов.
Предложенные селективные растворители не нашли применения из-за отсутствия их промышленного производства. В то же время большинство предложенных растворителей может быть получено с высоким выходом из доступного сырья. Так, 1Ч-метил - морфолинон-3 получается из диэтиленгликоля и метиламина по схеме, аналогичной способу производства N-метилпирролидона [105]:
-Но СН3КН2
0(СН2СН2ОН)2 — Г 1 1
СН3
N - Ацетилоксазолидин может производиться из этаноламина, формальдегида и уксусного ангидрида [106]:
СН2ОН +нс^° (Сн3со)2о
TOC o "1-5" h z СН2ЫН2 Хн N N
Н а А
Тиетан-1 - оксид, тиофан-1-оксид, 2-метилтиетан-1,1-диоксид получаются окислением соответствующих гетероциклических сульфидов пероксидом водорода [107].
Цианэтильные производные метилиденглицеринов легко получаются из глицерина, формальдегида и акрилонитрила [108]:
СН2ОН
I Р- сн2=снсы
СНОН + НСГ -► ( 1 + Г I —----------------- ►
I Н О СНоОН
Сн2он 2 он
0 СН2ОСН2СН2СЫ ОСН2СН2СЫ
Цианэтилированием тетрагидрофурфурилового спирта получается 2-тетрагидрофурфурилоксипропионитрил [109]:
+ СН2=СНСК —
О СН2ОН 0 СН2ОСН2СН2СК
Производство левулинонитрила может быть осуществлено, исходя из ацетона, формальдегида и синильной кислоты [110]
-Н20 нсы
СН3ССН3 + НС ^ —► СН3ССН=СН2 -------------- ► СН3ССН2СН2СМ
О ОО
Или из левулиновой кислоты:
20
|
-н2о |
|
II |
|
*ш2 |
|
О |
|
Сн3ссн2сн2соон + ын3 —► СН3ССН2СН2С^ |
|
II |
|
О |
|
|
К экстрагентам предъявляется еще и ряд технологических требований:
- плотность, отличающаяся от плотности сырья, - для быстрого расслаивания экстрактной и рафинатной фаз;
- температура кипения, отличающаяся от температуры кипения компонентов сырья, - для регенерации экстрагента из экстрактной фазы ректификацией;
- хорошая растворимость в воде и высокие коэффициенты распределения при экстракции водой из рафинатной фазы и экстракта;
- низкая вязкость, что повышает коэффициент полезного действия тарелок экстракционной колонны или снижает высоту, эквивалентную теоретической ступени экстракции;
- высокая термическая и гидролитическая стабильность - при температуре в колонне регенерации экстрагента из экстрактной фазы ректификацией с водяным паром;
- низкая коррозионная активность;
- невысокая температура плавления;
- низкая удельная теплоемкость и теплота испарения - для снижения энергозатрат при нагревании и глубокой регенерации экстрагента вакуумной ректификацией;
- доступность сырья для производства и низкая стоимость экстрагента;
- низкая токсичность;
- взрывобезопасность.
Физико-химические свойства экстрагентов, применяющихся в промышленности для выделения аренов С6-С8, представлены в табл. 4. Преимущества и недостатки применяющихся селективных растворителей сопоставлены в табл. 5 [111].
Компания «1ЮР» разработала и реализовала в промышленности в 1986 г. процесс «Каром» [112]. Экстракция аренов осуществляется смешанным растворителем на основе тетраэтилен - гликоля, в составе которого содержится до 20 %(об.) сораствори - теля, повышающего растворяющую способность по отношению к аренам. В 1994 г. процесс «Каром» использовался на четырех установках. Преимущество процесса по сравнению с экстракцией
|
Физико-химические свойства экстрагентов аренов
|
ТАБЛИЦА 5
Сравнительная характеристика селективных растворителей
|
Селективный растворитель |
![]()
|
Недостатки растворителя |
![]() Преимущества растворителя
Преимущества растворителя
Диэтиленгликоль
Триэтиленгликоль
Тетраэтиленгликоль
Сульфолан
Диметилсульфоксид
Достаточно высокая Ткип, низкая Ткрист, высокая плотность, относительно низкая стоимость, достаточно высокая стабильность, малая коррозионная активность, полная смешиваемость с водой и высокие коэффициенты распределения ДЭГ при водной отмывке рафинатной фазы и экстракта То же
То же (кроме Гкип)
Наивысшая групповая селективность по сравнению с другими экстрагентами, высокая плотность, низкая теплоемкость, достаточно высокая стабильность
Достаточно высокая групповая селективность (выше, чем у гликолей), низкая вязкость
Низкая растворяющая способность по отношению к аренам, невысокая групповая селективность, высокая селективность по молекулярным массам, низкие коэффициенты распределения аренов, высокая вязкость, высокая теплоемкость
То же, но растворяющая способность по отношению к аренам выше, чем у ДЭГ То же, но растворяющая способность выше, чем у ДЭГ и ТЭГ; чрезмерно высокая Ткт. что осложняет регенерацию тетраэтиленгликоля Меньшие коэффициенты распределения сульфолана при водной отмывке его из рафинатной фазы и экстракта, необходимость вакуумной отгонки аренов из экстрактной фазы, высокая ТКШС7 Низкая термическая и гидролитическая стабильность, что приводит к необходимости регенерации ДМСО реэкстракцией аренов низкокипящими алканами; невысокие растворяющая способность и коэффициенты распределения аренов
|
Л Л н « в * В то Ф ф |
|
О Я 5 Й га £ в » * ч Я Ф ей о о |
|
О Ф - Г В § § О Я Н ° Ф И д О, О Л с$ Ж рз *£ * « ^ К О 2 3 О ей Я В ? ч Г|1 I Ш А ^ п =? Н |
|
И * Я w Ф ^С. Ч ^ в о СО А О « « |
|
Диметилформамид Высокая растворяющая способность, Невысокая гидролитическая стабиль- Низкая вязкость ность; коррозионная активность; ток- |
|
К Ей » О О 3 И |
|
Й в А-94 Н В « ь |
|
3 я Я я 0 2° Ч ы О й |
|
« 3 * и 2 л § Й |
|
В 58 Р. О |
|
В С |
|
5 л В « | я О о Га £ Е- га О о ей га Р Е- Ей 2- й « |
|
Я Ей Й В ■& В К 6-1 о й - & & « ч м* З 8 * О кн X Ей В го |
|
Я $ 0 Я V Й о 1 § § н В к ^ ей „ к Н § о Я О ► Я 58 _ Л о а 5 5 Ф В о н ю га |
|
О |
|
Га га о в |
|
Й То « ^ й 5 й |
|
>> й? а 2 |
|
Л Ч ф Е- В а о |
|
Ч О Э Р. с § .Г ££ 6 в е - Э ф - § |
|
Га |
|
В4 ° В о я л и |
|
« Ей Й 5 3 в я |
|
Т Я К Н - 8 о ® в ^ К Р В й |
|
Га Й Я ей |
|
О |
|
Л ф Я Ю |
|
Я В Ч О ■& А О Я Ч В Я А О © |
|
Л О Ф О |
|
Л О Ф § О |
|
К Я© 11« и - ° |
|
« ® в ® « я в ■ £ я |
|
$ О Ж о и 8 КН Л ® И ^ ОС ® О Ч V Ф |
|
В Ч 0 £« 0 $ Ч |
|
2 Б К ей Я Л |
|
О к |
|
Ей |
|
О |
|
« ей 03 О в в >> » |
|
Ф я га £ СО Р> В О Е-1 Т В м « 2 ” га £ га о Й ей |
|
§ 1 Ич Ш В? ь >» 2 8 ей ф Й V га - В Ф Я £ |
|
А Л Ч 0 ^ Н ^ В ей Я Ф чО рн К Ю Ен <^> СО *м 1 Н « |
|
Ей К Га о н н 8 £ |й >> а 8 Ч В ф ф га а в в я |
|
Ей * 8 и о К 3 Ь К « ч ф о 4 & Ф сх О к |
|
О |
 |
|
|
|
|
|
|
|
|
|
Тетраэтиленгликолем - возможность снижения соотношения экстрагент : сырье с 4.3 до 3.0, что позволило снизить удельные энергозатраты на 16 % и повысить производительность установки на 25 %. В качестве преимущества отмечаются также очень низкие потери растворителя с экстрактом и рафинатом - 10 г/т.
Санкт-Петербургским государственным технологическим институтом совместно с ПО «Киришинефтеоргсинтез» предложено использование в качестве экстрагента аренов на установке ЛГ 35- 8/300Б вместо ТЭГ смесей ТЭГ - сульфолан [113, 114]. Перевод установки на смешанный экстрагент с повышенными селективностью и растворяющей способностью по отношению к аренам осуществляется в 2000 г. При содержании сульфолана в смешанном экстрагенте около 20 % (мае.) соотношение экстрагента к сырью может быть снижено с 10 до 6:1 (мае.) при соответствующем снижении удельных энергозатрат.
Учитывая меньшие коэффициенты распределения сульфолана по сравнению с ТЭГ при экстракционной отмывке водой из рафинатной фазы и экстракта, соотношение воды к рафинатной фазе было повышено в 2 раза - с 5 до 10 % (об.). Вследствие различного характера зависимости давления насыщенного пара (Р°) от температуры сульфолан, имеющий практически одинаковую нормальную температуру кипения с ТЭГ, при 150 °С (температуре в колонне отгона экстракта из экстрактной фазы) характеризуется вдвое большей величиной Р°- соответственно 3.8 и 1.9 кПа. Это приводит к повышенному попаданию сульфолана в экстракт по сравнению с ТЭГ. Экстрагенты, попавшие в экстракт, концентрируются в кубовом остатке толуольной колонны, т. е. в кси - лольной фракции. Водной промывкой ксилольной фракции, получающейся в небольшом количестве, были устранены потери сульфолана и ТЭГ с экстрактом.
Высокая эффективность смешанного экстрагента ТЭГ - сульфолан обусловлена отсутствием ассоциации молекул компонентов этой системы, как установлено калориметрическими исследованиями [115]. Как известно, слабо ассоциированные растворители - более эффективные разделяющие агенты по сравнению с ассоциированными за счет образования межмолекулярных водородных связей [16]. Кроме того, проявление положительных отклонений от закона Рауля в системе ТЭГ - сульфолан облегчает регенерацию смешанного экстрагента из экстрактной фазы, а практически одинаковые температуры кипения способствуют сохранению постоянства состава экстрагента.
Всем этим условиям (отсутствие ассоциации между молекулами, близость температур кипения, повышенная селективность и растворяющая способность по отношению к аренам) отвечает и
Смешанный экстрагент диэтиленгликоль - 1Ч-формилморфолйн [116], который предложено использовать вместо ДЭГ на установках экстракции аренов С6-С8 [117].
При экстракции аренов в экстракте остается небольшое количество [0.1-0.5 % (мае.)] примесей насыщенных углеводородов, ухудшающих качество в основном бензола. Для их удаления обычно используется простая ректификация, однако она недостаточно эффективна. Расход отгоняемой предбензольной фракции достигает 20 % (мае.) от расхода экстракта, но в связи с тем что не все примеси образуют азеотропы с бензолом, высококи - пящие насыщенные углеводороды остаются в кубовом остатке предбензольной колонны. Кроме того, рециркуляция предбензольной фракции в экстрактор приводит к снижению реального соотношения экстрагента к углеводородам, возврат наиболее трудноудаляемых примесей осложняет процесс экстракции.
Предложено вместо простой ректификации для удаления примесей из экстракта использовать азеотропную ректификацию с фэтеролом или высокооктановыми спиртами (2-пропанолом, трет-бутанолом и другими). Для удаления примесей достаточно небольших количеств азеотропобразующего компонента - до 3 % (мае.). Отгоняющийся тройной азеотроп, содержащий высокооктановый растворитель, насыщенные углеводороды и бензол, можно использовать как компонент бензина без регенерации азеотропобразующего агента [118].
В последние 10-15 лет исследования по поиску новых высокоселективных растворителей для выделения аренов из катали - затов риформинга и других смесей с неароматическими углеводородами ведутся менее интенсивно, чем ранее. В качестве новых экстрагентов аренов предложено использовать К-циклогек - си л - 2 - пиррол и дон [119] и его смеси с триэтиленгликолем [120]. В последнем случае рекомендуется проводить процесс экстракции при содержании ТЭГ в смешанном экстрагенте 74 % (мае.), температуре процесса 50 °С и оптимальном массовом соотношении экстрагент: сырье = 5.6 : 1.
Фирма «1ЮР» запатентовала в качестве экстрагентов аренов смеси полиалкиленгликолей, в частности тетраэтиленгликоля, с простыми моно - и диалкил - или арилэфирами гликолей [121-123].
Отмечаются высокая селективность и растворяющая способность по отношению к аренам 1Ч-алкил-2,4-диоксогексагидро- 1,3,5-триазинов. Эти растворители термически и химически устойчивы и могут быть использованы для выделения аренов в процессах экстракции или экстрактивной ректификации [124].
Для выделения аренов экстрактивной ректификацией предложены смеси 1Ч-метил-2-тиопирролидона с тетраэтиленглико-
26 лем, сульфоланом или М-((3-меркаптоэтил)-2-пирролидоном [125], а также N-алкилзамещенные производные морфолина [126, 127].
Однако все предложенные в последние годы экстрагенты и их смеси уступают по селективности к аренам наиболее эффективным растворителям - сульфолану и N-формилморфолину, применяющимся в промышленности.

 Опубликовано в
Опубликовано в