Исследования структуры лигнина шведскими химиками
 3 мая, 2013
3 мая, 2013  admin
admin |
Неон бсн3 |
Обширные работы шведских химиков, проводившиеся с целью изучения механизма сульфитной варки (см. главу XXVII «Сульфитная варка») привели к общему более широкому исследованию структуры лигнина. Ра
боты этих химиков нельзя рассматривать в отрыве от исследований в других важных направлениях по химии лигнина, в частности Фрейденберга и др. Близко к шведским работам примыкают работы некоторых японских исследователей.
Исследования были направлены в первую очередь на изучение так называемых «активных групп» лигнина. Б результате были развиты определенные представления о природе сульфирующихся групп лигнина (см. гл. XXVII). Исследования реакций сульфирования и алкилирования лигнина показали присутствие в лигнине групп бензилового спирта и его простого эфира, что было подтверждено далее методами классической органической химии.
Как известно, свойства лигнинов в значительной степени определяются условиями выделения их из растительных тканей, так как при выделении лигнины претерпевают более или менее глубокие изменения. В настоящее время шведские исследователи и многие другие признают, что наиболее близкими к природным лигнниам являются лигнины, выделенные из растительных материалов по способу, разработанному Бьеркманом (см. стр. 439).
Лигнин Бьеркмана, выделенный из ели, имеет молекулярный вес около И ООО (определение в ультрацентрифуге), что соответствует содержанию в молекуле примерно 60 фенилпропаиовых звеньев
Х----- х I I I
Но—<f с—с—с— >=/ I I I
С НдО
Средний эмпирический состав этого лигнина
^9^8.83^2.37(^^^3)0.86
Большая часть исследований шведских авторов проведена с использованием лигнина Бьеркмана. Адлер [по] подробно исследовал состав елового лигнина Бьеркмана: определил его функциональные группы и представил этот состав следующим образом — С8Н7 68 (фенольный ОН)С 28 (алифатический ОН)0 8в (ОСН3)0 96 (карбонильный О)018 (арил-алкильный простой эфирный О)0 71 (диалкильный простой эфирный О)0 33.
Методы исследования будут изложены ниже.
Одной из важнейших характеристик лигнина является содержание фенольных гидроксильных групп. Долгое время не удавалось разработать точных методов определения содержания фенольных гидроксилов. Лишь в последнее время были получены более или менее удовлетворительные результаты при помощи современных методов исследования, к которым относятся: 1) спектрофотометрический метод Аулин-Эрдтман (метод дифференциальных спектров, или Де-метод) [ш] и этот метод в модификации Голынмида [112]. Эти методы основаны на смещении ультрафиолетовых спектров поглощения лигнина в щелочной среде; 2) метод потенциометрического титрования в неводных средах (например, в этилендиамине), примененный Энквистом [113] и Фрейденбергом [114]; 3) метод кондуктометрического титрования, подробно исследованный Шюрхом и Сарканеиом [116]; 4) метод периодатного деметилирования лигнина (окисление NaJ04), предложенный Адлером [116]. При окислении лигнина NaJ04 по методу Адлера выделяется метиловый спирт в количестве, эквивалентном количеству свобод
ных фенольных гидроксилов. По количеству выделившегося метилового спирта судят о содержании фенольных гидроксилов
|
СНдОН |
|
.он осн. |
|
II и О |
|
II О |
НС СП
II I
[1С СООН
сооп
С помощью этого метода Адлер установил, что в лигнине Бьеркмана^ выделенном из ели, на каждые девять атомов углерода приходится около 0.3 моля свободных фенольных гидроксилов, т. е. примерно одна третья часть фенилпропановых единиц лигнина имеет свободные фенольные гидроксильные группы, а две трети фенилпропановых единиц должны быть вовлечены в простые эфирные связи.
Как уже говорилось, Адлер нашел в лигнине Бьеркмана алифатические гидроксильные группы в количестве 0.86 моля на фенилпропановую единицу Св—С3, причем было показано, что из них около 0.36 моля составляют первичные спиртовые группы и около 0.5 моля — вторичные. Образование при этанолизе лигнина продуктов, содержащих концевые метильные группы, обусловлено наличием свободных первичных спиртовых групп (спиртовых гидроксилов в у-положешш боковой цепи). Эти первичные спиртовые группы служат источником образования формальдегида при обработке лигнина 28%-й серной кислотой [е3' 10°].
Адлер и Гирер [117J показали, что часть спиртовых гидроксилов лигнина легко метилируется метиловым спиртом в присутствии 0.5% НС1. При помощи модельных реакций установили, что эти гидроксильные группы являются группами бензилового спирта.
|
+ сш=<_ У |
|
=0 |
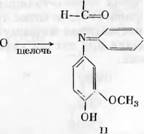
Гирер [118] определял группы бензилового спирта в модельных веществах и в лигнине по реакции с хинонмонохлоримидом в щелочном растворе. Гирер установил, что при действии на лигнин хинонмонохлор - имида образуется синий гваяцшшндофенол (II), причем на модельных веществах было показано, что реакция возможна лишь для соединений гваяцилкарбинольного типа, содержащих в гваяцильном ядре свободный фенольный гидроксил (I)
Н—С—ОН I
J
Лигнин лиственной древесины, кроме гваяцилиндофенола (2-метокси - фенолиндофенола), дает сирингилиндофенол (2,6-диметоксифенолиндо - фенол). Оба этих производных можно выделить в кристаллической форме. Группы /г-оксибензилового спирта в «конденсированных» (в 5-м положении) единицах лигнина переходят в соответствующие «конденсированные»
индофенолъные группы, которые продолжают быть связанными с остатками лигнина
N=s
|
=0 |
H
/V^OCH,
СН I
| Он
Адлер [119] подтвердил наличие в лигнине групп /г-оксибензилового •спирта или его эфира также с помощью характерных цветных реакций, а именно путем переведения n-оксибензилового спирта в так называемые хинонметидные группы. Если соединение, содержащее группу и-окси - 3-метоксибензилового спирта (I) или его алкилового эфира (II), обработать бромистым водородом в хлороформе, то по приведенной ниже схеме получается тг-окси-З-метоксибензилбромид (III). При обработке этого бромида слабым основанием, например пиридином или бикарбонатом натрия, происходит отщепление бромистого водорода и образуется характерный хинонметид (IV)
Снов
I
J
Vxoch,
ОН
II
|
СНВг |
|
NaHCOa |
|
НВг + |
|
Осн.. |
|
ОН III |
R0H+ снсъ '
Сн II
F I
ОСН3
IV
Здесь R = Н или алкилу.
Хинонметидные производные далее определялись спектрофотометри - чески. Хинонметиды представляют соединения желтого цвета с характерным максимумом поглощения ультрафиолетового излучения в области 320—340 тц.
Хинонметидпая реакция изучалась Адлером сначала на модельных соединениях, в том числе а-гваяцилпропаноле (V), и р-гваяциловом эфире гваяцилглицерина ^Vrl), а затем проводилась с еловым «нативным» лигнином. В случае лигнина максимум поглощения ультрафиолетового излучения наблюдался при тех же характерных длинах волн, как и у модельных соединений.
|
СН3 I СН2 I СНОН I |
|
СН20Н СН—о—<F~ I = |
|
> |
|
СН°Н О-СНз П YX°CH3 ОН VI |
|
V^OCH, Он V |
Наряду с гидроксильными группами лигнины могут содержать карбонильные группы. По данным Адлера [12°], в лигнине Бьеркмана содержится одна группа кониферилового альдегида со свободным фенольным гидроксилом (VII) на 100 элементарных фенилпропановых звеньев и одна группа кониферилового альдегида с этерифицированным фенольным гидроксилом (VIII) на 35—40 элементарных звеньев
|
С/Н |
|
СН=СН—с/ | ^0 А |
|
СН=СН - I |
|
Уосп3 он |
|
УЧзсНз о |
VIII
В конифериловом альдегиде карбонильная группа копъюгирована ■с двойной связью, которая, в свою очередь, конъюгирована с ядром. Предполагают, что цветная реакция лигнина с флороглюцином и соляной кислотой обусловлена возникновением именно этой хромофорной системы.
Важнейшим моментом в изучении структуры лигнина является установление характера связи между отдельными фенилпропановыми единицами лигнина. Этот вопрос до сих пор еще окончательно не разрешен.
Как уже говорилось, Адлером было установлено, что в лигнине Бьеркмана только около одной трети фенольных гидроксилов является свободной, а две трети примерно вовлечены в простую эфирную связь. Большинство исследователей в настоящее время считает, что простая эфирная связь является основным типом связи между мономерными звеньями лигнина.
|
VII |
До сих пор не получено никаких указаний на существование в лигПине диарильных простых эфирных группировок. Это позволяет сделать вывод о наличии в лигнинах алкил-арильных простых эфирных связей. Следовательно, кислород фенольного гидроксила должен быть связан с одним из трех углеродных атомов (а, |3 или у) боковой цепи соседнего мономера
-f у�СН8
НС------- о
I
|
—С— -С - |
|
ОСНо |
|
НС I |
СНОН I
I О СН3
СНг - о
I
—С— СНОН
|
Уосн3 ОН Р |
|
У�СН3 Он |
|
Уосн3 он |
Адлер [121] считает, что связь фенольного гидроксила с а-углеродным атомом (а-алкиларильная связь) маловероятна, так как в мягких условиях сульфирования или алкилирования (СН3ОН + НС1) в этом случае должны 31 H. И. Никитин
%
Были бы освобождаться в значительных количествах фенольные гидроксилы. В экспериментах же такого явления не наблюдали. Группировки типа ()- и у-алкилариловых простых эфиров являются более устойчивыми. Поэтому в лигнине можно ожидать наличия этого типа связей. К такому же выводу пришла и Шорыгина (см. стр. 477).
Адлер на основании многочисленных экспериментов с модельными веществами предположил, что в лигнине имеются структуры типа Р-арилового эфира гваядилглицерина (IX). Было найдено, что модельные вещества подобной структуры дают реакции, типичные для лигнина. При нагревании с крепкой серной кислотой первичная спиртовая группа этих соединений образует формальдегид. Вторичная спиртовая группа легко сульфируется в кислом растворе, а при обработке метанолом в присутствии HG1 при 20° С легко метилируется.
НСНО
СН2ОН
|
28%-я H, SOt |

|
СН2ОН Jh-O-/ |
|
ОСНо |
|
Кипячение с обратным холодильником |
|
> |
|
> |
СН—о------ /
-S03H 0CHi
I
|
|
|
СНОН |
И
�CHo
Он
СН2ОН
Сн-0—<(^3 н-с-осн3 /
I
|
Уосн3 ОН (IX) |
|
|
^/осн3 Он
Еще большее значение имело открытие, что эти модельные вещества при нагревании с этанолом в присутствии НС1 дают такие же простые эфиры кетоспиртов, кетоны и дикетоны, какие были пол} чены Гиббертом при этанолизе лигнина. Недавно было показано [ш], что подобные реакции происходят и при нагревании лигнина и модельных соединений со смесью диоксана с водой (9:1) в присутствии 0.2 N НС1. В этих условиях модельные соединения типа IX давали гваякол и кетоны Гибберта, содержащие концевые метильные группы. Реакция идет по такой схеме
СНоОН
»';он ОСН3
Ь
У ХОСН3
СН2ОН
С—О
|
СН2ОН I Сон I |
|
СН2ОН I Со I Сн2 |
|
=/ |
|
/ Осн3 |
II
|
Н - |
|
+ |
|
Он |
|
Ч оснч |
|
ОСН, |
|
13 Он он |
Сн 5 I
В образующихся производных происходят перегруппировки по схеме, предложенной Гиббертом (см. стр. 470)
R—СН2—СО—СН2ОН < > В—СН—С(ОН)—СН2ОН R—СН(ОН)—С(ОН)=СН2 ^
R—СНОН—СО—СН3 R—С(ОН)—С(ОН)—СН3 R—СО—СНОН—СН3, а также диспропорционирование
2R—СНОН—CO-CHg —> R— СО—СО—СН3 + R—СН2— СО—СН3.
Эту схему Адлер предлагает и для объяснения процесса этанолиза лигнина, протекающего с одновременной этерификацией соединений: R—СНОН—СО—СНо^к В—СО—СНОН—СН3. Определив в продуктах кислотного гидролиза лигнинов (диоксанлигнина и ддгнина Бьеркмана) содержание свободных фенольных гидроксилов и концевых метальных групп и сравнив полученные аналитические данные с результатами, полученными при 1*1слотном гидролизе вышеупомянутого модельного вещества, Адлер показал, что примерно 1/4—а/3 всех фенилпропановых единиц лигнина входит в состав группировок, имеющих структуру Р-арилового эфира гваяцилглицерина (IX).
Точку зрения Адлера подтверждают результаты исследования повторного этанолиза елового этаноллигнина, полученные Шюрхом с сотрудниками [123]. Опыты показали, что примерно 40—60°/о фенилпропановых единиц лигнина очень быстро связывают этоксильные группы без образования новых фенольных гидроксилов. Одновременно, но более медленно, протекает реакция образования свободных фенольных гидроксилов и карбонильных групп в отношении примерно 1:1. Такое поведение лигнина совпадало с поведением модельных соединений типа р ариловых эфиров гваяцилглицерина. По мнению авторов, реакция идет по следующей схеме
СН2ОН СН—О—/
|
Сн2он СН-0-/ |
|
Лч |
|
)СН |
I 3 НС1 I
V '^осн
|
СН3 Снос2н5 I Со I А |
|
СНз <!О I CHOC2Hs I |
|
+ |
|
Уосн3 он |
|
У�СНз он |
|
Уосн3 он |
Также получаются соединения: R—СН2—СО—СН3 и R—СО—СО—СН3. Эти же соединения находят в продуктах этанолиза лигнина.
Предположение о наличии в лигнине простых эфирных (3-алкилариль - ных связей было сделано в последнее время и Фрейденбергом [136>ш], выделившим из продуктов энзиматической дегидрополимеризации кониферилового спирта, приводящей к получению искусственного лигнина (так называемого DHP), (3-конифериловый эфир гваяцилглицерина (X) (см. стр. 493).
Как уже говорилось, по данным шведских исследователей, в простую эфирную связь (типа (3-арилового эфира) вовлечено примерно 30% фенил - пропановых единиц. Остальные фенилпропановые звенья должны быть соединены связями каких-то других типов. Современные знания о дегидрогенизации и полимеризации фенолов позволяют предсказать, что фенилпропановые единицы лигнина могут быть связаны двумя типами связи: простой эфирной связью типа |3-арилового эфира (XI) и углерод-углеродной связью за счет |3-углеродного атома боковой цепи одного мономера и 5-го углеродного атома ароматического кольца другого (XII)
|
I —С— I —с— I —с— I А |
|
СН2ОН I СН II СН I |
|
—с— I —С— —с— —с— А I |
I I d
|
—с— I —с— |
|
V^OCH, -о |
|
Л- •I А Уосн3 —о Xi |
СН——о
Снон I
V4OCH,
X
I Учосп, г
Xii
Леопольд [124] синтезировал ряд модельных соединений, содержащих простые эфирные связи типа XI и углерод-углеродные связи типаХП, и подверг их нитробензольному окислению в щелочной среде. Соединения типа XI давали хороший выход ванилина, а соединения типа XII, имеющие только углерод-углеродные связи, почти не давали ванилина.
Сравнение результатов этих опытов с результатами нитробензольного окисления лигнина показало, что в лигнине наряду с простыми эфирными связями должны иметься и углерод-углеродные связи, распределенные, вероятно, в случайном порядке.
Еще в 30-х годах Фрейденбергом [92] было сделано предположение о наличии в лигнине ели фенилкумарановых структур (см. стр. 464), причем в то время он предполагал, что лигнин ели в основном состоит из таких элементов. В последнее время Фрейденберг считает, что дегидро- диконифериловый спирт (XIII) является одним из основных димеров, входящих в состав лигнина. Этот продукт был также выделен Фрейденбергом в ходе синтеза DHP (стр. 493). Экспериментальные данные, полученные Адлером [по], позволяют сделать некоторые заключения о содержании в лигнине структур типа дегидродикониферилового спирта. Опыты с модельными веществами показали, что при кислотном гидролизе, а именно при нагревании с метанолом или диоксаном в присутствии НС1, насыщенная структура фенилкумарана (содержащаяся в дегидродиконифериловом спирте) превращается в ненасыщенную структуру фенилкумарона (XIV) с непрерывно конъюгированными двойными связями. В результате этого превращения наблюдается характерное измене лие ультрафиолетового спектра поглощения.
|
СН |
СН2ОН СН2ОН
СН
.
|
СН2ОН I С/ |
СН2ОН I
/Ч/ ОС1Т3 снзон + о^нсц ~/Ч/�СНз
НС I
|
-о |
Нс-
-о
|
П У^ОСНз он XIV |
|
Уосн3 он XIII |
Исследование ультрафиолетового спектра поглощения лигнина Бьеркмана до и после обработки метанолом в присутствии НС1 показало, что в лигнине содержится не более 5—7 % структуры фенилкумарана. Примерно такого же мнения придерживается в настоящее время и Фрейденберг.
Углерод-углеродная связь между 5-м углеродным атомом ароматического кольца и (i-углеродным атомом боковой цепочки соседнего мономера существует в лигнине не только в виде кумаранового цикла, но и в виде открытой структуры (XV). В пользу этого предположения говорят опыты Фрейденберга [18в] по получению меченой изогемипиновой кислоты (XVI) из DHP, полученного из меченного (С14 в (З-положении) кониферилового спирта. В этом опыте окисление DHP перманганатом калия проводилось без предварительного сплавления со щелочью, которое могло бы вызвать расщепление фуранового цикла. Существование открытых структур подтверждается и опытами Рихтценхайна [125], который при^окислении
Соон I
НООС^УЧ°СНз ОСН3 XVI
Перманганатом метилированной древесины получал примерно удвоенный выход изогемипиновой кислоты в том случае, если перед метилированием и окислением производилось сплавление древесины со щелочью. Если сплавление не производилось, выход составлял 1—2%. Выход изогемипиновой кислоты удваивался, по-видимому, за счет открытия фуранового цикла при щелочной обработке.
Возможные типы связей в лигнине этим не исчерпываются. Шведские химики считают, что в лигнине мономерные фенилпропановые единицы могут быть соединены всеми тремя типами связи, которые имеются в продуктах дегидрополимеризации кониферилового спирта, полученных Фрей - денбергом, а именно связями типа простого p-арилового эфира (X), связями типа дегидродикониферилового спирта — фенилкумарановая структура (XIII) и связями лигнанового типа — структура пинорезинола (XVII). Относительно действительного количества структур пинорезинола в лигнине пока имеется очень мало сведений. По мнению Адлера [110], оно не превышает 10—20% от всех фенилпропановых единиц лигнипа (для лигнина Бьеркмана).
ОН
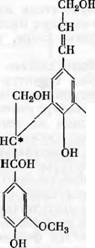
|
ОСИ» |
|
Xv |
А/0™»
/X
I I
Сн—сн
I I
Сн сн2
|
Он |
|
Xix |
|
Xviii |
£
Voch4
|
Сно сно |
|
—С— —с— I I |
|
I |
|
I |
|
C, h5nO, NaoIT' |
|
/V СН30 I Он |
|
~уосн3 он |
|
Сн. |
|
Он |
Xvii
Кроме того, недавно было подтверждено наличие в лигнине небольшого количества дифенильных связей (XVIII). Как показал Пью [126], при окислении лигнина нитробензолом в щелочной среде наряду с большим количеством ванилина получается небольшой процент дегидродивани - лина (XIX). При модельных экспериментах этот продукт получался лишь при окислении соединений, имеющих дифенильные связи. Спектрохими - ческие исследования Аулин- Эрдтмаи также указывают на присутствие в лигнине дифенильной структуры.
Наряду с углерод-углеродными связями между ароматическим кольцом и боковой цепью или между двумя ароматическими кольцами возможно также существование углерод-углеродных мостиков в положениях а-а, а-р и Примером структуры последнего типа является пинорезинол. a-fS-Углерод-углеродные связи (XX), по предположению Фрейден - берга [127], образуются путем полимеризации ненасыщенных боковых цепей кониферилового спирта
TOC o "1-3" h z СН2ОП СН2ОН
I I
—сн I
|
Уосн3 0 1 |
|
У�СН3 О |
Л
|
СН I |
|
СН I |
0
1
Xx
О присутствии в лигнине углерод-углеродных связей между а-угле - родными атомами боковых цепей (XXI) говорит получение небольших количеств производных стильбена при окислении лигносульфоновых кислот гидратом окиси меди в щелочи [128]
|
I I —С— —С— I I —с— —с— I I НС----------- сн I I А |
|
I
|
|
Сч(ОН), NaOH ' |
O/V V^OCH.
I
Он
|
Сн3о/у он |
|
Уосп3 он |
|
Сн. |
|
Он |
Xxi
Шведские исследователи не отрицают возможности реакций углерода в у-положении боковой цепи и возможного участия первичных спиртовых гидроксилов лигнина в образовании связей между фенилпропановыми звеньями. По мнению Шорыгиной (см. стр. 477), в пользу существования простых эфирных связей в у-положении говорит получение сравнительно больших количеств дигидроэвгенола при разложении лигнина металлическим натрием в жидком аммиаке.
Из всего сказанного вытекает, что лигнины имеют весьма сложную и многообразную структуру. Этим свойством отличается даже наиболее
Простой и близкий к природному лигнину представитель этих веществ — лигнин Бьеркмана.
Все предположения относительно возможных структур и связей в лигнине Адлер представил в виде единой схемы (схема № 1). Он считает, что среди различного типа связей в лигнине преобладающими являются связи простого p-арилового эфира (структуры типа р-гваяцилового эфира гваяцилглицерина). Кроме того, могут образоваться, например, дифе - нильные связи 5-5, углерод-углеродные связи между р-углеродиым атомом боковой цепи и 5-м углеродным атомом ароматического кольца соседней фенилпропановой единицы (фенилкумарановая или соответствующая открытая структура), а также структуры типа пннорезинола. Приблизительно каждое третье гваяцильное ядро имеет свободный фенольный гидроксил. Цепь оканчивается группой кониферилового спирта или кониферилового альдегида. Вместо этих ненасыщенных звеньев могут присно сн2он
I TOC o "1-3" h z I
Сн сн2 сн2он
II I I
СН НС,----------- сн
|
А |
|
У ^осн3 неон I —о—С— I —о |
А А
.) г..
Н2сон уОСНз у�СНз НС о —о
|
УЧОСНз ОН |
Он }
ЕнзОчД
I "
Н3с/0ч-1н
! I НС - сн
L I
НС .сн2 I чк //
1 А
/пгтт- Н2СОн! |
Н2сон ^хосн. . .
Ht_I 1/УЧоои -
I НС он
HCOH |
I неон
Н2С0Н| II
L/Y^CH,
НС
НС----- о
I
//
1
Н2СОН YOCHs
НС------ о
I
Неон
Г)
У^ОСНз
ОН
Схема JN5 1
Сутствовать димерные или полимерные структуры, описанные Фрейден - бергом. Кроме концевых групп кониферилового альдегида, карбонильные группы должны содержаться и в насыщенных боковых цепях, но пока их положение еще окончательно не установлено. Безусловно, эти карбонильные группы играют определенную роль в различных реакциях лигнина, в том числе и в процессе сульфирования t129].
Предлагая примерную схему присутствующих в лигнине структур и связей, Адлер подчеркивает, что она не является структурной формулой лигнина, а лишь дает представление о возможных группировках и связях в молекуле лигнина.

 Опубликовано в
Опубликовано в