ИСПОЛЬЗОВАНИЕ СТИРОЛА ДЛЯ ПОЛУЧЕНИЯ МОНОМЕРНЫХ ПРОДУКТОВ
 7 августа, 2013
7 августа, 2013  admin
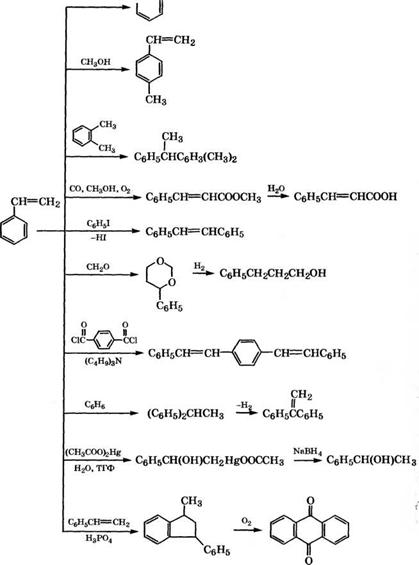
admin Основные направления потребления стирола связаны с производством полистирола и полимеров. Однако на основе стирола получают и ряд мономерных продуктов (рис. 7), на что расходуется, например, в Западной Европе около 6.5 % всего объема потребления стирола [107].
При окислении стирола воздухом в толуоле при 90 °С в качестве главных продуктов образуются стиролоксид с выходом 18-25 % и бензальдегид с выходом 40-45 % [108]. С повышением конверсии стирола выход стиролоксида возрастает, а бен - зальдегида - снижается. Стиролоксид является ценным промежуточным продуктом при получении фенилгликоля, 2-фенил- этанола, фенилацетальдегида, фенилуксусной кислоты, находит применение при производстве лаковых смол, гетинаксов, полиэфиров, электроизоляционных материалов.
Селективность образования оксида стирола повышается при каталитическом эпоксидировании стирола. Так, при использовании в качестве катализатора 15 % (мае.) Ag, промотированно - го СвЖ)3, на подложке из 84.7 % (мае.) А1203, 13.4 % (мае.) 8Ю2 с примесями других оксидов, в результате окисления кислородсодержащим газом при 250 °С и объемной скорости 3600 ч1, при конверсии стирола 66 % селективность образования стиролоксида составила 95 % [109].
Получение стиролоксида вдзможно при низкотемпературном окислении стирола 30 % - м Н202 [110] или 60 % - м Н202 [111]. Так,
|
Рис. 7. Направления использования стирола для получения мономерных продуктов |
В последнем случае при эпоксидировании в присутствии катализатора - бис(триалкилоловоокси)молибденовой кислоты и неорганического аниона (вО^ ) в гетерогенной среде вода - метилхло - рид при 20 °С конверсия стирола составила 69 %, селективность 89 % и выход стиролоксида 59 %.
Достаточно хорошие результаты получены и при эпоксидировании стирола гидропероксидами кумила [112] или трет - бутила [113]. Селективность образования стиролоксида повышается при модифицировании молибденовых катализаторов борсодержащими соединениями [114,115]. Действительно, с добавлением трибутилбората при эпоксидировании стирола ку - милгидропероксидом при 100 °С, мольном соотношении стирол : : гидропероксид : В : Мо = 2 : 1 : 0.02 : 0.0003 в присутствии гидрохинона в качестве ингибитора выход стиролоксида повысился с 66.8 до 79.5 %, а выход полимеров снизился с 20.5 до 10 % [112].
Недостатки использования кумилгидропероксида для эпок- сидирования стирола: образование смеси высококипящих продуктов с близкими температурами кипения, в частности стиролоксида и диметилфенилкарбинола (соответственно 194 и 202 °С), которые трудно разделить ректификацией. Преимущество применения /тгр^/тг-бутилгидропероксида состоит в образовании низ - кокипящего гарега-бутанола, что позволяет вести разделение продуктов реакции в мягких условиях. При добавлении трибутилбората и мольном соотношении стирол : гарет-бутилгидро - пероксид: В : Мо = 2:1: 0.02 : 0.0003 при 90 °С выход стиролоксида повышается с 71 до 95 % на исходный стирол, а выход полимеров снижается с 4.5 до 1.7% [113].
Прямым алкилированием стирола метанолом на цеолитных катализаторах может быть получен п-метилстирол - перспективный мономер для производства новых пластмасс [116]. Однако процесс алкилирования многомаршрутный [117, 118]: алки - лирование стирола идет как в ядро, так и в боковую цепь с образованием как п-, так и о-, м-, а - и Р-метилстиролов; в качестве побочных продуктов образуются толуол, ксилолы, метилэтил - бензолы, тетраметилбензолы; обнаружены также продукты дис - пропорционирования стирола - бензол и дивинилбензолы; в результате вторичных процессов дегидроциклизации о-дивинил - бензола и о-метилстирола образуются нафталин и инден, при вторичном метилировании - диметилстиролы и т. д. Добиться высокой селективности образования п-метилстирола можно лишь сочетанием нескольких методов модифицирования пентасиловых катализаторов, которые позволяют изменить не только спектр кислотной силы центров, но и их доступность. х мо
Исследовано модифицирование пентасилов добавками Р,
Ьа, Ее, однако и при оптимальных условиях с использованием модифицированных цеолитов селективность по сумме метилсти - ролов составляет всего 26 % [119]. Поэтому более эффективный метод получения п-метил стирола - дегидрирование /г-этилтолу - ола, получаемого этилированием толуола.
Взаимодействием стирола с о-ксилолом при 130-170 °С и давлении 0Л-0.5 МПа в присутствии аморфного катализатора, приготовленного совместным осаждением гидроксидов А1 и 81, можно получать 1-фенил-1-ксилилэтан, обладающий хорошими диэлектрическими свойствами [120]. Взаимодействием стирола с этилбензолом в присутствии цеолитов типа Ь в Н+-форме, в которых Н+ частично обменены на катионы двух - и трехвалентных металлов (Си, N1, Со, Zn, Ее, Мп, редкоземельные элементы), получен димер стирола с конверсией 100 % и селективностью свыше 84 % [121]. Димер стирола и другие 1,1-диарилэтаны, полученные взаимодействием гомологов стирола с алкилбензо - лами, пригодны в качестве электроизоляционных масел, компонентов смазок и композиций для бумаг, чувствительных к давлению.
Взаимодействием стирола с бензолом при 180-230 °С и давлении 1-13 МПа в присутствии кислотных гетерогенных катализаторов (цеолитов типа (3 или Н-У, морденита) получают 1,1-ди - фенилэтан, используемый для производства 1,1-дифенилэтена - сомономера для производства пластмасс [122]. Фирма «ВАвЕ АО» запатентовала способ получения 1,1-дифенилэтанов взаимодействием бензола и стирола или его замещенных производных с использованием в качестве катализатора цеолитов типа г8М-20 или ЕМТ. Выход 1,1-дифенилэтана при 50 °С и продолжительности реакции 3 ч составляет 28.4 % при селективности по 1,1-дифенилэтану 56 % [123].
Фенилирование стирола иодбензолом по реакции Хека, катализируемое комплексами палладия, приводит к образованию стильбена [124]. Катализаторы могут быть как гомогенные, так и гетерогенные (Рс1/С, Рс1/8Ю2, палладиевая чернь). Установлено, что и в последнем случае реакция идет по гомогенному механизму - катализ осуществляется комплексами, переходящими в жидкую фазу.
Алкилированием стирола терефталоилхлоридом в кипящем ксилоле в присутствии трибутиламина и катализатора (Рс1/С) может быть получен транс, транс-п-дистирилбензол [125].
При конденсации стирола с формальдегидом по реакции Принса образуется 4-фенил-1,3-диоксан, каталитическим гидро - генолизом которого получают 3-фенилпропанол (гидрокоричный
Спирт) [126]. Гидрокоричный спирт - душистое вещество с гиацинтоподобным запахом, применяющееся в парфюмерной промышленности, а также в качестве эмульгатора. Недостаток метода получения гидрокоричного спирта - невысокий выход (не более 67 %) и трудности, связанные с очисткой от близкокипя - щего 4-фенил-1,3-диоксана. Предложен метод очистки взаимодействием гидрокоричного спирта с борной кислотой:
ЗС6Н5(СН2)30Н + Н3В03 — [С6Н5(СН2)30]3В + ЗН20
4- Фенил-1,3-диоксан не реагирует с борной кислотой и может быть отогнан от трис(3-фенилпропил)бората в присутствии инертного растворителя - сульфолана. Затем гидролизом бората получают очищенный гидрокоричный спирт.
Гидрокоричный спирт может быть получен также гидрированием коричного альдегида:
С6Н5СН=СН2СНО С6Н5(СН2)3ОН
Взаимодействием стирола с оксидом углерода, спиртами и кислородом в присутствии Р(1-содержащих катализаторов [127] или соединений Рс1 и комплексов [МпСи2С12(ОАс)4]„ или их гидратов [128] можно получать циннаматы - эфиры коричной кислоты, например метилциннамат, с выходом 98.5 %. Циннаматы используют при составлении парфюмерных композиций и пищевых эссенций, для получения фенилаланина, сельскохозяйственных химикатов.
Гидролизом циннаматов можно получать коричную кислоту [129]. Коричная кислота нетоксична, обладает антибактериальным и противогрибковым действием, ее применяют как консервант пищевых продуктов. Используется она и для получения фенилацетальдегида, а также транс-Р-бромстирола:
TOC o "1-5" h z Вг 2 №2С03
С6Н5СН=СНСООН ------------- ► С6Н5СНВгСНВгСООН ---------------- ► *
— С6Н5СН=СНВг 1
тракс-Р-Бромстирол - душистое вещество, применяющееся для ароматизации мыла, а также в парфюмерии.
Один из способов получения антрахинона основан на диме- ризации стирола в присутствии Н3Р04 в 1-метил-З-фенилиндан с последующим окислением в антрахинон воздухом на ванадиевом катализаторе или сначала в 2-бензоилбензойную кислоту (окислители - Н1ЧОз или воздух в уксусной кислоте в присутствии Со2+) и ее циклизацией [130].

 Опубликовано в
Опубликовано в