АНТРАЦЕН И АНТРАХИНОН
 24 августа, 2013
24 августа, 2013  admin
admin Важнейшая область применения антрацена - производство
9,10- антрахинона. Уже в начале 1980-х годов мировые мощности по производству антрахинона составляли около 35 тыс. т/год, причем 85 % антрахинона производилось окислением антрацена [91].
Газофазное окисление антрацена воздухом осуществляется при 360-380 °С над У205 с добавками К2804, Ге304 на носителе вЮ2 в реакторах с псевдоожиженным или стационарным слоем катализатора. Выход антрахинона составляет 81-82 %.
Окисление антрацена в жидкой фазе проводится хромовой кислотой в водной среде при 60-105 °С: к суспензии антрацена добавляют 48 %-й раствор Н2804 и 20 %-й раствор Ка2Сг207. В качестве окислителя в промышленности используется также ШЧ03: антрацен в органическом растворителе, например трихлор - бензоле, нагревают с 10-20 %-й НЖ)3, содержащей 1-4 % (мае.) Н2804, при 100-120 °С.
В качестве катализаторной системы для газофазного окисления антрацена в антрахинон предложена смесь оксидов следующего состава, % (мае.): У205 3.1-3.3; ТЮ2 4.2-4.4; Ге203 1.4-1.8; оксид Мп 0.3-0.5; К20 3.2-3.4; Св20 0.5-0.7; инертный носитель стеатит - остальное [92].
Жидкофазное окисление антрацена предложено проводить 30 % -м Н202 в присутствии ацетилацетоната ванадия в диоксане при 10-100 °С. Выход антрахинона чистотой около 99 % превышает 99 % [93]. В качестве гомогенного катализатора при окислении антрацена в виде суспензии в метаноле 10-80 %-м водным раствором Н202 запатентованы также соединения Ее2+ или Со2+ [94].
Окисление антрацена Н202 возможно в присутствии оксидных ванадиевых бронз СихУ205 (д: = 0.3-1.0) в уксусной кислоте или диметилформамиде при 60-90 °С. При продолжительности реакции 3 ч достигается практически полная конверсия антрацена, однако селективность образования антрахинона составляет лишь 80 %. Отмечается высокая селективность при окислении антрацена кислородом воздуха в присутствии катализатора, содержащего Се, при 100-120 °С в тех же растворителях [95].
Основные направления применения антрахинона представлены на схеме (рис. 19).
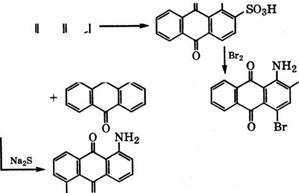
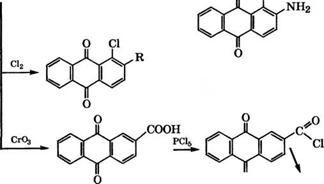
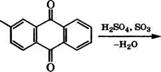
Сульфированием антрахинона 20-40 % - м олеумом в присутствии Н£804 или соединений Т1 и Р<1 при 100-150 °С получают 1- антрахинонсульфокислоту. При сульфировании без катализатора сульфогруппа вступает в (3-положение [20]. Дальнейшее сульфирование 1-антрахинонсульфокислоты нри более высокой температуре приводит к образованию смеси 1,5- и 1,8-дисульфокислот.
Хлорированием 1-антрахинонсульфокислоты в олеуме получают 5,8-дихлорантрахинон-1-сульфокислоту и далее -
1,5,8- трихлорантрахинон, применяющийся в синтезе кубовых красителей.
|
О N02 02^ О N02 |
|
О о |
|
|
||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
![]()
![]()
![]()
![]()
![]()
|
СН(ОН)(СН2ОН)2 |
![]()
|
Н28047п |
![]()
|
О |
![]()
 ОСН2СН—СН2
ОСН2СН—СН2
|
Н2С—СНСН2С1 О |
ОСН2СН—СН2
Рис. 19 (продолжение)
При щелочном плавлении 2-антрахинонсульфокислоты при 185 °С в присутствии КаЖ)3 в промышленности получается 1,2-дигидроксиантрахинон (ализарин). Ализарин, добывавшийся из корней красильной морены, применялся для крашения тканей в синий цвет еще в Древнем Египте и Индии. Ализарин является промежуточным продуктом в производстве ряда красителей и лаков, применяющихся для приготовления художественных и полиграфических красок.
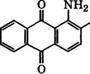
Аммонолизом К-соли антрахинон-1-сульфокислоты в 25- 30 %-х водных растворах МН3 или метиламина при 120-180 °С в присутствии ж-нитробензолсульфокислоты в промышленности синтезируют 1-амино - или 1-метиламиноантрахинон соответственно.
1- Аминоантрахинон получают также восстановлением 1-нит - роантрахинона, синтезируемого нитрованием антрахинона нитрующей смесью концентрированных НГ"Ю3 и Н2804. Так, при 60 °С получен следующий состав реакционной смеси, % (мае.): 1- нитроантрахинон - 77, 2-нитроантрахинон - 4, динитроантрахи - ноны - 15, антрахинон - 3 [91].
Нитрованием 1-нитроантрахинона при более высокой температуре получают смесь 1,5- и 1,8-динитроантрахинонов с выходом 40.5 и 36.2 % соответственно. При нагревании 1-нитроантрахинона и 1,5-динитроантрахинона с 25 %-м водным раствором ГШ3 при 150-170 °С в растворителях (хлорбензоле, ксилолах, сульфолане) образуются соответственно 1-амино - и 1,5-диаминоантрахиноны. 1,5- и 1,8-Диаминоантрахиноны получают также кипячением соответствующих динитроантрахи - нонов в водном растворе Ка28.
В Киотском университете разработана и использована в промышленности новая технология нитрования ароматических соединений, в том числе антрахинона, оксидами азота в присутствии озона (в основном, системой М02/03). Применение Кедай - процесса дает возможность легко получать 1-нитроантрахинон при меньшем загрязнении окружающей среды [96].
1,5- , 1,8- и 2,6-Диаминоантрахиноны производятся также аммонолизом соответствующих антрахинондисульфокислот в присутствии окислителя - ж-нитробензолсульфокислоты.
Частичным аммонолизом 1,5- или 1,8-антрахинондисульфо- кислоты с последующим взаимодействием полученных аминоан - трахинонсульфокислот со спиртовым раствором алкоголята и гидролизом аминоалкоксиантрахинонов в концентрированной Н2804 получают 1,5- или 1,8-аминогидроксиантрахинон.
|
I |
![]() Взаимодействием 1-аминоантрахинона с хлорсульфоновой кислотой в нитробензоле или полихлоридах синтезируют 1-ами-
Взаимодействием 1-аминоантрахинона с хлорсульфоновой кислотой в нитробензоле или полихлоридах синтезируют 1-ами-
ноантрахинон-2-сульфокислоту, бромированием которой Вг2 при
5- 15 °С производится 1-амино-4-бромантрахинон-2-сульфокис - лота (бромаминовая кислота). Замещением брома в бромамино - вой кислоте на NHC6H5 или NHAlk реакцией с аминами в присутствии солей Си и слабых оснований (NaHC03, CH3COONa) производятся светопрочные кислотные красители типа 1-амино - 4-арил(или алкил)аминоантрахинон-2-сульфокислот. При конденсации бромаминовой кислоты нагреванием в слабокислой среде в присутствии соединений Си образуется 1,1'-бис(4-амино - антрахинон-3-сульфокислота), применяющаяся в синтезе красного пигмента [91]:
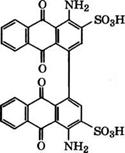
|
О NH2 |
![]()
|
S03H |
![]()
|
О Вг |
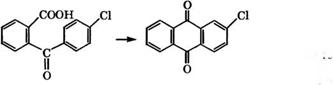
2- Аминоантрахинон получают аммонолизом 2-хлорантра - хинона при 205 °С в присутствии Си!304. 2-Хлорантрахинон производится в промышленности циклодегидратацией 2-(4'-хлор- бензоил)бензойной кислоты при Н£1ГреваНИИ в 16%-м олеуме [20]:
|
|
|
J |
![]() Недостатки этого процесса - большие количества используемых кислотных реагентов (на 1 т 2-хлорантрахинона приходится 2.4 т 24 %-го олеума и 0.7 т купоросного масла) и образующихся кислых сточных вод - 13.6 т с концентрацией Н2804 43-50 %. Разработана малоотходная технология синтеза 2-хлорантрахинона с заменой олеума на твердый кислотный катализатор - асканит-бентонит активированный. Циклодегидратация
Недостатки этого процесса - большие количества используемых кислотных реагентов (на 1 т 2-хлорантрахинона приходится 2.4 т 24 %-го олеума и 0.7 т купоросного масла) и образующихся кислых сточных вод - 13.6 т с концентрацией Н2804 43-50 %. Разработана малоотходная технология синтеза 2-хлорантрахинона с заменой олеума на твердый кислотный катализатор - асканит-бентонит активированный. Циклодегидратация
2- (4'-хлорбензоил)бензойной кислоты проводится при 300-310 °С, выход 2-хлорантрахинона составляет 70-80 % [97].
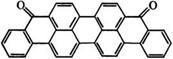
Наиболее широко для производства антрахиноновых красителей применяются следующие производные антрахинона [98, 99]: 1-аминоантрахинон (37 красителей), 1,4-диоксиан - трахинон (хинизарин) (24), бромаминовая кислота (24), 2-ами- ноантрахинон (23), 1,5-диаминоантрахинон (19), 1-амино-5- бензоиламиноантрахинон (13). Среди полициклических производных антрахинона наиболее важен дибензантрон (виолан - трон):
|
|
На основе виолантрона синтезировано 17 красителей.
Антрон, или 9(10Н)антраценон, получают восстановлением антрахинона оловом в смеси уксусной и концентрированной соляной кислот при 110-118 °С. В качестве восстановителей можно также использовать А1 в концентрированной Н2в04 или Ее и НС1.
Бензантрон, или бензо[е?,е]антрацен-7-он, производится в промышленности конденсацией антрахинона с глицерином в концентрированной Н2804 при 110-115°С в присутствии Zn и Сив04 в качестве восстановителей.
Антрахиноновые красители отличаются яркостью, высокой устойчивостью красок, однако и более высокой стоимостью по сравнению со многими другими красителями. Они занимают ведущее положение среди кубовых красителей. Первый кубовый краситель - индантрон, открытый в 1901 г. и до сих пор выпускаемый промышленностью, получают щелочным плавлением
2- аминоантрахинона в смеси КОН, КаОН и СН3СООКа в присутствии окислителя - КаЖ)3 при 225 °С [79, 80]:
О
Индантрон - синий полициклический кубовый краситель и пигмент, устойчивый при нагревании на воздухе до 500 °С, в концентрированной НС1 - до 400 °С, в расплавленной щелочи - до 300 °С. Хлорпроизводное индантрона получается аналогичным щелочным плавлением 2-амино-З-хлорантрахинона или хлорированием индантрона.
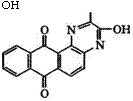
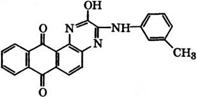
Взаимодействием 1,2-диаминоантрахинона со щавелевой кислотой и последующим араминированием ж-толуидином синтезируют ярко-алый кубовый краситель, относящийся к группе антрахинонпиразинов:
|
ОН |
|
КН2 СООН + I СООН |
|
|
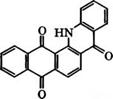
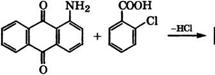 Взаимодействием 1-аминоантрахинона с о-галогенкарбоно - выми кислотами с последующей циклизацией под действием концентрированной Н2804, НЯ03С1 или других дегидратирующих агентов получают фталоилакридоны:
Взаимодействием 1-аминоантрахинона с о-галогенкарбоно - выми кислотами с последующей циклизацией под действием концентрированной Н2804, НЯ03С1 или других дегидратирующих агентов получают фталоилакридоны:
Соон ~н2°^ о
|
|
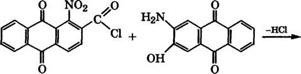
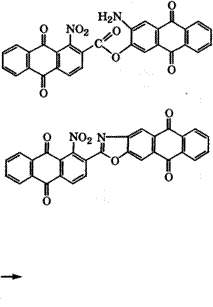
В качестве кубовых красителей применяются также антра - хиноназолы - производные антрахинона, содержащие азольный цикл (азола, тиазола, оксадиазола). Так, красный кубовый краситель получают взаимодействием хлорангидрида 1-нитрохи- нон-2-карбоновой кислоты с 2-амино-3-гидроксиантрахиноном с последующей циклизацией в концентрированной Н2в04 и аммо - нолизом нитрогруппы:
|
|
|
|
|
Н2804 -НоО* |
|
ЫНя |
 Тиазольный аналог - полициклический кубовый краситель красно-фиолетовый синтезируют действием того же хлорангидрида на 2-амино-З-хлорантрахинон с последующим аммоноли - зом нитрогруппы, замещением хлора на группу БН действием Ка2Б и циклизацией в концентрированной Н2804.
Тиазольный аналог - полициклический кубовый краситель красно-фиолетовый синтезируют действием того же хлорангидрида на 2-амино-З-хлорантрахинон с последующим аммоноли - зом нитрогруппы, замещением хлора на группу БН действием Ка2Б и циклизацией в концентрированной Н2804.
Широко применяются кислотные антрахиноновые красители, имеющие сульфогруппы, следующего строения:
Они не имеют конкурентов в других классах красителей, так как обеспечивают наиболее яркие и устойчивые окраски на шерсти и полиамидных волокнах, например кислотный фиолетовый антрахиноновый краситель
(И! = Н; Иг = К = ОС12Н25)
И кислотный синий антрахиноновый Н53 [99]
К2 = - нО-0-^>803Н; И = Н)
Исходный 1,4-диаминоантрахинон получают взаимодействием лейкоформы 1,4-дигидроксиантрахинона (хинизарина) с 1ЧН3 при 110-120 °С с последующим окислением образовавшегося лейкосоединения диамина воздухом или в растворе нитробензола, служащего окислителем [91]:
|
|
|
Кн3 |
|
НО О |
|
ОН ИН |
![]()
|
О2 |
![]()
|
ОН 1ГО |
![]()
Производные антрахинона широко применяются и в качестве жирорастворимых красителей, хорошо растворимых в неполярных и малополярных органических растворителях. Так,
1.4- диизопропиламиноантрахинон используется как краситель для бензинов. Для крашения пластмасс применяются производные антрахинона, содержащие одну или две ариламиногруп - пы: 1,8- или 1,5-бис(л-толуидино)антрахинон (фиолетовый),
1.4- бис(2,4,6-триметиланилино)антрахинон (ярко-синий), 2-бром- 1-амино-4-(п-толуидино)антрахинон (голубой), 1,4-бис(п-толу - идино)антрахинон (зеленый) [17].
Антрахиноновые красители играют важную роль и в группе дисперсных красителей, применяющихся для крашения и печатания синтетических волокон в виде высокодисперсных водных суспензий.
Так, находят применение как дисперсные красители розовый Ж (I) и синий К - смесь соединений с основным компонентом (II) [100, 101]:
|
О КНСН3
|
|
9 Кн2 |
![]()
|
ОСНя |
![]()
 О ГШ(СН2)2ОН п
О ГШ(СН2)2ОН п
Для окрашивания пластмасс и полимерных смол производные антрахинона можно вводить в состав макромолекул на стадии полимеризации или поликонденсации.
Антрахиноновые красители применяются в производстве чернил и чернильных паст, в том числе использующихся в принтерах. Антрахиноновые пигменты и лаки, например алюминиевые комплексы ди - и полиоксиантрахиноновых красителей, применяются в производстве полиграфических красок, при окраске автомобилей, как кроющие, защитные и декоративные составы.
Производные антрахинона, в частности 3-метоксибензан - трон, используются и как органические люминофоры. На основе дневных флуоресцентных пигментов - твердых растворов люминофоров в поликонденсационных смолах - получают эмалевые, художественные, печатные флуоресцентные краски. Люминофоры применяются и в оптических квантовых генераторах и сцинтилляторах. Так, 9,10-дифенилантрацен используется в качестве люминесцирующего компонента в жидких и пластмассовых сцинтилляторах для детектирования ионизирующих а-, (3-, у - и нейтронного излучений [91].
Ряд противоопухолевых средств синтезирован на основе производных антрахинона - дауномицин
|
|
|
ОН |
![]() А также аметантрон и митоксантрон: X О ЫНСН2СН2ГШСН2СН2ОН
А также аметантрон и митоксантрон: X О ЫНСН2СН2ГШСН2СН2ОН
X = Н аметантрон X = ОН митоксантрон
1,8-Диоксиантрахинон применяется в качестве лекарственного средства против лейкемии [102].
Производные антрахинона обладают антибактериальными и антивирусными свойствами, например гиперицин [99]:
|
|
Ряд производных антрахинона находит применение для лечения псориаза и других кожных заболеваний, а также мозговых и нервных расстройств.
Антрахинон-1- и 2-карбоновые кислоты и их хлорзамещен - ные производные используются в качестве гербицидов.
Добавление каталитических количеств антрахинона ускоряет процесс делигнификации древесины, повышает выход целлюлозы при сульфатной и натронной варках на 8-10 % [103]. Показана возможность повышения эффективности классической методики щелочного нитробензольного окисления лигнинов путем применения катализаторов окислительно-восстановительного типа - антрахинона или о-фенантролина. Так, в присутствии антрахинона выход ароматических альдегидов при щелочном нитробензольном окислении лигнинов из древесины осины возрастает с 39.1 до 61.1 % (мае.) [104].
Антрахинон и его производные сенсибилизируют фотодеструкцию полимеров, в связи с чем нашли применение для утилизации отходов упаковочных материалов из полиэтилена. Продолжительность фотодеструкции полимерных материалов удалось снизить с нескольких лет до месяцев и даже дней, что является важной экологической проблемой.
Хинизарин, ализарин, полиоксиантрахиноны применяются в качестве ингибиторов окисления трансформаторных масел и масел для авиационных турбин.
Антрахинон и его галоген - и 2-алкилпроизводные используются как фотоинициаторы в составе фотополимеризующихся композиций. Фотоотверждаемые полимерные материалы применяются для изготовления оптических полимерных линз, оптических дисков и других систем записи и хранения информации [105].
Производные антрахинона используются также как химикаты для электрофотографических процессов и как фотохром - ные вещества в устройствах для записи, хранения и обработки информации, для защиты глаз от солнечного излучения.
Взаимодействием антрахинона и его производных с избытком эпихлоргидрина в присутствии гидросульфита Ма в щелочной среде в атмосфере инертного газа при 40-55 °С получены диглицидиловые эфиры 9,10-диоксиантраценов [106]
ОСН2СН—СН2 Г 1Г Т Л К = Н, С1,С2Н5
ОСН2СН—СН2 чо
Эти диглицидиловые эфиры предложено использовать в качестве основы оптических клеев [107].
Большое практическое значение имеют также 2-алкилантра- хиноны, получаемые конденсацией фталевого ангидрида с ал - килбензолами или диеновым синтезом из нафтохинона и 2-ал - килбутадиенов [91].
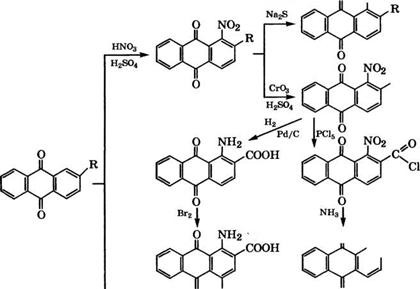
Нитрованием 2-метилантрахинона получают 1-нитро-2-метил- антрахинон, на основе которого синтезируют 1-амино-2-метил - антрахинон, 1-нитро - и 1-амино-2-антрахинонкарбоновые кислоты (рис. 20). Хлорированием 2-метилантрахинона С12 или сульфурилхлоридом производится 1-хлор-2-метилантрахинон. Полученные производные 2-метилантрахинона применяются в качестве промежуточных продуктов при синтезе антрахиноновых красителей.
1- Аминоантрахинон-2-карбоновая кислота образуется с количественным выходом при гидрировании 1-нитроантрахинон-2- карбоновой кислоты в присутствии Р(1/С в водно-щелочной среде при 90 °С и давлении 5 МПа.
При кипячении 1-нитроантрахинон-2-карбоновой кислоты с РС15 образуется хлорангидрид, обработкой которого спиртовым раствором КНз получают амид. Последний при нагревании с водно-щелочным раствором КаСЮ по реакции Гофмана превращается в 2-амино-1-нитроантрахинон.
Бромированием 1-аминоантрахинон-2-карбоновой кислоты в концентрированной Н2804 при 90 °С получают 1-амино-4-бром - антрахинон-2-карбоновую кислоту.
|
О N02 |
![]()
|
Сн3соон |
![]()
|
О кубовые красители |
![]()
|
ОН |
![]()
![]()
|
Соон |
![]()
|
О Вг |
![]()
|
О ШСЮ^аОН |
![]()
|
О N02 о ^ N112 |
![]() О2
О2
Н202 +
Рис. 20. Направления использования 2-алкилантрахинонов
Взаимодействием хлорангидрида 1-нитроантрахинон-2-кар - боновой кислоты с гидразингидратом в хлорбензоле получают гидразид, который после циклизации в олеуме при 85-90 °С и последующего аммонолиза превращается в краситель антрахи - ноновый кубовый бордо [91]:
|
|
|
С1 ^гН4 • Н2Р^ |
|
О N02 /N11— N11 |
|
Ч О О |
 О N02 N—N N02 О ч0
О N02 N—N N02 О ч0
|
|
|
О N112 N—N N^0
|
Окислением 2-метилантрахинона Сг03 в уксусной кислоте получают антрахинон-2-карбоновую кислоту, хлорангидрид которой используется в производстве кубовых красителей.
2- Алкилантрахиноны (прежде всего, 2-этилантрахинон) широко применяются в промышленном производстве пероксида водорода [108]. Каталитическим гидрированием 2-алкилантра - хинона получают 2-алкилантрагидрохинон, при последующем окислении которого воздухом образуется пероксид, количественно распадающийся на Н202 и 2-алкилантрахинон:
Таким образом, в результате 2-алкилантрахинон остается неизменным, выступая в качестве катализатора. Стадия гидрирования проводится на скелетном №, губчатом Р<1 или Рс1 на носителе - А1203. Процесс проводят в смеси бензола с вторичными спиртами. Наличие алкильного заместителя обеспечивает высокую растворимость окисленной и восстановленной форм 2-ал - килантрахинона в органической среде. Образовавшийся Н202 экстрагируют водой и концентрируют ректификацией, а органический слой очищают, сушат и возвращают в цикл. Свыше 80 % мирового производства пероксида водорода обеспечивается ан - трахиноновым методом.
Экологически чистый метод синтеза 2-этилантрахинона разработан И. И. Моисеевым с сотрудниками [109].
Работы по совершенствованию способа получения 2-этилантрахинона продолжаются и в настоящее время.
Взаимодействием фталевого ангидрида с этилбензолом в жидкой смеси НЕ и ВЕ3 получают комплекс 2-(4'-этилбензо - ил)бензойной кислоты, разложением которого в вакууме при температуре не выше 60 °С получают твердую кислоту, при циклизации которой образуется 2-этилантрахинон [110]:
Твердая 2-(4'-этилбензоил)бензойная кислота вводится в количестве 15-20 % (мас.) в концентрированную Н2804 или олеум, и циклизация проводится при 80-90 °С.
Антрахиноны образуются и при проведении реакции фталевого ангидрида с алкилбензолами в присутствии цеолитов при температуре около 200 °С [111].

 Опубликовано в
Опубликовано в