Интегральные модели переноса вещества в сложных системах
 4 июня, 2013
4 июня, 2013  admin
admin Интегральная модель ориентирована на тот случай, когда процесс массообмена между фазами протекает самопроизвольно вследствие разности между рабочими и равновесными концентрациями вещества в каждой точке объема аппарата.
Сложности формирования поверхности межфазного взаимодействия, особенности гидродинамики течения для каждого типа массообменного аппарата концентрируются в коэффициенте массоотдачи. Его определяют, обобщая экспериментальные дан-
Ные уравнениями массопередачи, которые представим для двухфазных систем на базе модели 0 межфазной турбулентности в форме
|
А, |
![]()
|
К I / Т£) I т ‘'ОЛТ ______ ^ 1 |
![]() = (1+/); (10.13)
= (1+/); (10.13)
)"' (1 + /). (Ю.14)
Где } — фактор гидродинамического состояния двухфазной системы; г, ж — индексы газовой (паровой) и жидкой фаз.
При 1 = 0 уравнения (10.13), (10.14) переходят в уравнения массопередачи, получаемые из пленочной теории массообмена в двухфазных системах. Тогда количество вещества для газовой фазы, переносимое из элемента объема через поверхность получим из уравнения
ЙМ = Коу{у — уР)йР. (10.15)
Аналогично для жидкой фазы
ЙМ = Кох (*р — х) йР. (10.16)
Равновесные концентрации и линии фазового равновесия.
В двухфазных системах в результате массообмена за бесконечное время наступает термодинамическое равновесие. Равновесное состояние системы определяется согласно правилу фаз Л/+Ф = к + 2 (10.17), где /V — число степеней свободы; Ф — число фаз; к — число компонентов.
В качестве параметров обычно фиксируются концентрация компонента в жидкой фазе х, парциальное давление над жидкостью Р и температура
При анализе двухфазных систем с двумя компонентами в качестве параметров могут быть выбраны следующие: х— содержание низкокипящего компонента жидкости; Р — парциальное давление; х, I — температура; у, х — содержание низкокипящего компонента в паре и в жидкости. Соответственно равновесные соотношения представляются в графиках х—р; х— у—х.
При малой концентрации распределяемого компонента связь между параметрами Р и х определяем по закону Генри:
УР = ^хА, (10.18)
Где ф — константа Генри; Р — полное давление в системе; ха— содержание распределяемого компонента А в жидкой фазе; ур — равновесное содержание того же компонента в газовой (паровой) фазе. Значение константы Генри зависит от свойств газа, жидкости и температуры.
Рассматриваются идеальные системы, для которых справедлив закон Рауля. Этот закон устанавливает линейную связь между содержанием летучего компонента в жидкости, находящейся в равновесии с паром, и его парциальной упругостью: Р = = ха. Ра (10.19), где Р — парциальное давление компонента над смесью; хА—молярная доля компонента в жидкости; рА—давление паров индивидуального компонента А.
Следуя выкладкам [34], получаем уравнение для равновесной концентрации компонента в газовой (паровой) фазе:
•ь-ТП^ТУТГ' (10'20)
Где а — относительная летучесть компонента А,
А = Ра/Рб - (10.21)
Здесь ра, Рв — упругость паров компонентов А и В. В — труднолетучий компонент. Уравнение (10.20) используется для построения диаграммы равновесия. Если в равновесии находятся фазы, для которых законы идеальных газов и идеальных жидкостей не действительны, то равновесные концентрации г/р=: = f(x) определяются экспериментально или по справочной литературе.
Рабочая концентрация и линии рабочих концентраций. Начальные и конечные концентрации компонентов в фазовых потоках бывают заданы. Заданные и фактические концентрации фазовых потоков в аппаратах называются рабочими концентрациями. Рабочие концентрации распределяемого вещества не равны равновесным и в действующих аппаратах никогда не достигают равновесных значений.
Зависимость между рабочими концентрациями y=f(x) называется рабочей линией процесса. Вид функции y=f(x) для всех массообменных аппаратов получается из уравнений материального баланса.
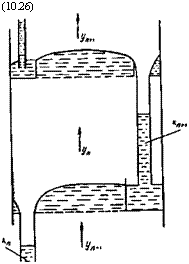
Пусть в аппарат (рис. 10.2) сверху поступает Lsl, а снизу
Отводится LK жидкой фазы с массовым содержанием компонен
Та А, соответственноравным ха и хк. Газовая фаза G„ поступает снизу и отводится сверху G* е массовым содержанием компонента А, соответственно равным у„ и ук.
Запишем условия материального баланса по всему веществу и данному компоненту для аппарата:
GH + L„ = GK - j - Z. K; (10.22)
Gut/.I + LuxH = GKyK -)- LKXn. (10.23)
Представим уравнения баланса всего вещества и компонента А для некоторого сечения аппарата:
0„ + /. = 0+£к; (10.24)
(*нУн --Ьх = йу + (10.25)
Из последнего получим уравнение - рабочей линии
|
(10.26) |
 I — внУн — 1кдгк
I — внУн — 1кдгк
«<А
Рис. 10.2. Схема потоков в ректификационной колонне
Рис. 10,Зі. Схема тарельчатого элемента ректификационной колонны
Выражающее связь между рабочими концентрациями распределяемого компонента в произвольном сечении аппарата. Если расходы фаз постоянны по высоте аппарата, рабочая линия — прямая.
Средняя движущая сила процесса переноса и число единиц переноса. Отклонение состояния вещества от состояния равновесия характеризуется разностью равновесной и рабочей концентраций компонента в одной фазе. Разности концентраций Аг/р и Длгр определяют процесс массопередачи и представляют собой движущую силу процесса.
Запишем уравнение материального баланса в элементе аппарата высотой с1„ с поверхностью фазового контакта с! Р, в котором изменение материального потока вещества по высоте приравнивается к диффузионному потоку через поверхность:
ЙМ = — вс{у = К1/(у — У?)йР. (10.27)
Разделив переменные и выполнив интегрирование, получим
К/ г _йу_. (10 28)
0 3 у-ур
Ук
Так как М — С(уи— г/к), то из уравнения (10.28) найдем
М = КуР-Ун-~-'к = К^ьГу. (10.29)
Ун
|
1-2 |
![]() <1у
<1у
Ур
Н
При линейной зависимости равновесных концентраций среднюю движущую силу процесса по высоте противоточного аппарата определим как среднелогарифмическую [31]. Когда рабочая лнния лежит выше линии равновесия, имеем
(Уп ~ Упр) ~ {У(п—1) У(п - 1)р)
|
П р |
![]() У ~ ---- у „—упт, : (10.30)
У ~ ---- у „—упт, : (10.30)
2,318
У(п-1) — У(п-1)р
(*(ге+1)р хп+) ~ (*пр хп)
Аа:— ‘ .(Ю.31)
2,31я-("+1)р П+1
Хпр ~ *п
Ин аче
- (Упр Уп) (У(п - 1)р У[п-])) .
УПр-уп > (Ю.32)
’ % У(П-1)Р-УП-Х
- (жя+1 Лл+Пр)- (ХП~ хпр)
Дл: = :—х------ ГГТ---------- • (10.33)
Хп хпр
Выражения для средней движущей силы, когда рабочая линия процесса в аппаратах промежуточного типа ниже равновесной, имеют вид
Уп — Уп-1
АУ = ------------------ Уп ~Уп 1 (10,34 )
2.3
Е Уп р — Уп
Й ----------- -+1 . (10.35)
2.3 ]8 _2±! 122.
Хп — *пр
Рассмотрим некоторый элемент массообменного аппарата (рис. 10.3).
Примем, что жидкость на вышележащей тарелке имеет конечную концентрацию хл+|. На нижележащей тарелке эта концентрация изменяется до хп. Пар, поступающий на нижнюю тарелку, имеет концентрацию ул_х и изменяется до уп.
Если расхвд пара С, то количество вещества, переходящего из
Одной фазы в другую, определяется из уравнения
М = в(уп — уп-). (10.36)
Это же количество распределяемого между фазами компонента может быть записано е виде (10.29): М — КуРАу. Принимая, что р = аУт, где Ут — объем жидкости на тарелке, м3; а — удельная поверхность фазового контакта, м2/м3, получаем
М = К„УпЬу. (10.37)
Сопоставляя уравнения (10.36), (10.37), находим
|
(10.38) |
![]() __ Уп Уп—1 _____ Куу^т
__ Уп Уп—1 _____ Куу^т
|
I/ |
![]() Д у С,
Д у С,
Соотношение (10.38) называется числом единиц переноса и представляет собой отношение изменения рабочих концентраций к средней движущей силе.
Если принять ^ = 6/^ (/„ — рабочая площадь сечения тарелки, м2; Ь — удельная поверхность фазового контакта, м2/м2), то уравнение для определения количества компонента, переходящего из одной фазы в другую, можно записать в виде
М = КиЬ}тЬу = КЛтЬу. (10.39)
Тогда число единиц переноса
Уп Уп~
Щт=~Ту----------- = (Ю.40)
Используя выражения (10.34), (10.35) для аппаратов смешанного типа, выражения для числа единиц переноса запишем так:
|
Упр Уп—I Тп Хп+1 Хпу |
|
Т |
|
Ут |
|
Тхт = 2,3 ]ё (Ю 42) Хпр Связь между коэффициентами массопередачи и массоотдачи. Процесс массопередачи включает в себя массоотдачу в пределах каждой из взаимодействующих фаз и перенос распределяемого вещества через границу (поверхность) раздела фаз. Поэтому Уравнение массопередачи для конечного элемента имеет вид М (д — (10.43); М = К, (хр - х) Р. (10.44) |
|
- 2.318 ; (10.41) Упр Уп |

Если концентрации фаз изменяются при движении вдоль поверхности раздела, уравнение (10.43) записывается в форме (10.29). Аналогично можно представить и уравнение (10.44).
Допустим, что распределяемое вещество переходит из паровой фазы в жидкую и движущая сила выражается в концентрациях паровой фазы, тогда количество вещества, переходящее из фазы в фазу, определяется уравнением (10.43).
Ввиду сложности механизма массоотдачи в объеме фазы принимают
М = РУР(у — угр) (10.45); М = $ХР (хгр — х), (10.46)
Где у, Угр — концентрации компонента соответственно в ядре и на границе паровой фазы; х, хгр — то же для жидкой фазы.
Чтобы установить связь между коэффициентами массоотдачи
(3* и коэффициентами массопередачи Ку и Кх, принимают, что на границе раздела фаз достигается равновесие. Это значит, что сопротивлением переноса через границу можно пренебречь.
Рассмотрим случай, когда равновесная зависимость линейна, т. е. ур = тх. Тогда с учетом принятых допущений
М = Уг—~. (Ю.47)
|
Или Из уравнения (10.46) имеем |
![]() Мт
Мт
Утр Ур р р • (10.48)
У-Уг (10-49)
Сложив соотношения (10.49) и (10.48), получим
Y-^=-r(j;+ j;)' (10-50)
Подставив уравнение (10.50) в (10.43), найдем
1 г- + -5—. (Ю.51)
|
Аналогично запишем |
— = —4--J—. (10.52)
При криволинейной зависимости yP=f(x) величина m изменяется по высоте аппарата и, следовательно, изменяется коэффициент массопередачи. В этом случае всю область разбивают на участки, в пределах которых m постоянно, и для аппарата задают разные значения К-
Состав фаз, способы выражения состава. Фазовые потоки в массообменных аппаратах представляют собой смеси двух и большего количества компонентов. Если смесь состоит из компонентов А, В,. N, молекулярные массы которых Мл, М_в, ^ Мц и массовые доли ха, хв, ■ •> хы для каждой фазы и ул, Ув, ■ ■
|
У.' Дл НЫ |
|
*і/ м< іш*А Ук/ МК |
|
N |
|
Паровой фазы ук = |
|
Для |
|
N V Массовое содержание любого компонента на ходим из соотношений |
|
Я паровой фазы, то содержание любого компонента в моль- Долях определяем по следующим уравнениям: *к/ Ч Чля жидкои фазы хк |
|
Рис. 11.1. Схема ректификационной установки непрерывного действ ия: 1 — дефлегматор; 2 — колонна; 3 — кипятильник |
|
Ректификационные установки предназначены для разделения жидких смесей на практически чистые компоненты или фракции, различающиеся температурой кипения. Физическая сущность процесса ректификации заключается в двухстороннем массо - и теплообмене между неравновесными потоками пара и жидкости. При контакте паров смеси с жидкой смесью, вследствие того что температура паров смеси выше температуры кипения низ - кокипящего компонента, но ниже высококипящего, происходит испарение из жидкой смеси низкокипящего компонента и конденсация из паровой смеси высококипящего компонента. В результате многократного повторения массообмена пар обогащается низкокипящим компонентом, а жидкость — высококипящим. Ректификационные установки включают ряд теплообменных аппаратов для подготовки рабочего процесса, вспомогательное оборудование и ректификационную колонну (рис. 11.1), в которой осуществляется процесс ректификации. |
|
|

 Опубликовано в
Опубликовано в