МОДЕЛЬНЫЕ РЕАКЦИИ
 24 апреля, 2013
24 апреля, 2013  admin
admin Наиболее точные данные о продуктах, образующихся прнг поликонденсации в различных условиях, можно получать с помощью бумажной хроматографии [54]. Впервые этот метод (одномерную хроматографию) для фенолоформальдегидных смол применил Фримэн [55]. В качестве элюента он брал смесь бутанола с аммиаком (в соотношении 4:1), с помощью которой можно разделять одноядерные фенолосшфты и двухъядерные п, гг'-бис(2,6- диоксиметилоксифенил)метаны. Позднее с помощью двухмерной хроматографии удалось добиться значительно лучшего разделения фракций [8]. По этому способу в качестве элюента сначала применяют воду, а зат£м — смесь бутанола с аммиаком. Элюирование* водой обеспечивает разделение по числу фенольных ядер, содержащихся в молекуле, а элюирование смесью бутанола с аммиаком — дифференцирование по числу метилольных групп.
Одноядерные фенолоспирты имеют наибольшую миграционную способность, несколько меньше она для двухъядерных и наименьшая — для трехъядерных фенолоспиртов (элюент вода).
Соединения с наибольшим числом метилольных групп, например триоксиметилфенол, бис(диоксиметилоксифенил)метаны, имеют наименьший показатель миграции (элюент Ви/ГШ3). Полимети - ленфенолы также хорошо разделяются и идентифицируются. Большие величины показателя миграции характерны для о, п - и тг, тг'-изомеров, значительно меньшие — для о, о'-изомеров (табл. 2.2).
|
Таблица 2.2. Показатели миграции различных фенольных соединений
* — показатель миграции при элюировании водой; Н/д — при элюировании Смесью Ви/ГШз (4:1). |
Для визуального выявления отдельных соединений высушенную бумагу опрыскивали 0,5%-ным содовым раствором, при этом на бумаге появлялись желто-оранжевые пятна.
Кэмерер с сотр. [56] исследовали продукты, в которых фенольные ядра соединены в о, о'-положениях метиленовыми или ди - метиленэфирными мостиками.
Как установили Цинке и Эйлер, при конденсации 2,6-бис(окси- метил)-4-метилфенола образуются линейные продукты, которые при 130 °С (температура отщепления формальдегида) содержат около 90% диметиленэфирных мостиков. Отщепление воды начинается приблизительно при той же температуре, что и отщепление формальдегида. Следы ионов натрия, имеющиеся при получении диоксиметиленфенола и влияющие на отщепление формальдегида, удалялись тщательной очисткой продукта.
Синтезированы двухъядерные [57], трехъядерные и высшие линейные многоядерные соединения, например:
ОН ОН ОН, ОН
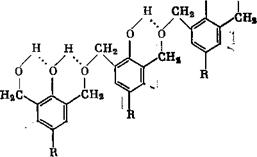
Многоядерные соединения получали по аналогичной схеме. 2,4,6-Трис(оксиметил)фенол может образовывать трех - и четырехъядерные циклические соединения. Ниже показаны структурные модели многоядерных циклических соединений с диметиленэфир - ными мостиками [58]:
Нон2с^Д^сн2-о-сн2><^^сн2он
|
Сн2 |
|
О / |
|
_ |
|
Н2С |
|
|
|
|
|
Но^у^он |
![]()
|
Сн2он |
![]() Где И — алкильные группы.
Где И — алкильные группы.
До сих пор считается, что пара-замещенные фенолы, присоединяясь друг к другу в орто-положенин, образуют в основном линейные продукты поликонденсации. При конденсации в присутствии кислых катализаторов в алкилфенольных новолаках образуются преимущественно метиленовые, а при конденсации в присутствии щелочей — главным образом диметилэфирные связи. Концевые метилольные группы способны при 150 °С взаимодействовать между собой или с другими ненасыщенными группами с отщеплением воды. Аналогичными свойствами обладают диметиленэфирные группы. Эти группы обеспечивают способность смол к дальнейшей подиконденсации с нецасыщенными соединениями, например с маслами [59].
Молекулярные массы алкилфенольных смол с длинноцепными заместителями составляют около 1000 [49].
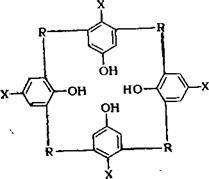
Особый случай представляет синтез циклических продуктов поликонденсации на основе формальдегида и гсара-замещенных фенолов. Циклические соединения с высокой температурой плавления, состоящие из 4 фенольных ядер [60], образуются при нагревании полученных в щелочной среде п-алкилдиоксиметилфенолов в льняном масле или парафине:
|
|
Где X алкильный или арильный радикал; —СНа— или
—СН2-0—СН2—.
Выход кристаллических продуктов поликонденсации составляет 60—80%. Их выделяют спиртом из расплавов диметилоль - ных производных тг-треиг-бутилфенола и гг-октилфенола, образующихся при 130—140 °С. При фракционированном разделении спирторастворимых циклических продуктов поликонденсации из смеси продуктов с преимущественным содержанием п-трет,-бутил- диоксиметилфенола было выделено соединение с температурой плавления 245 °С.
Кэмерер и Хауб [61] получили единые по структуре и молекулярному составу продукты поликонденсации замещенного п-кре - зола, содержащего функциональные группы.
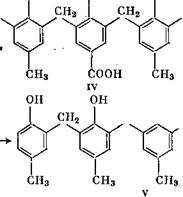
Кебнер [62] из этилового эфира 2,6-диоксимётил-тг-оксибензой- ной кислоты (I) и тг-крезола синтезировал трехъядерное соединение {II), которое легко омылялось до кислоты (III):
|
-2Н20 |
|
НС1 |
|
III |
|
Соон |
|
СН3 |
|
СООС2Н5 I ОН ОН ОН |
|
|
||
|
|||
|
|||
|
|||
|
|||
|
|||
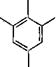
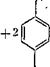
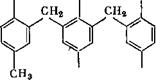
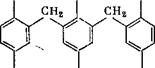
Соединение (III) способно присоединить метилольные группы в оба ориго-положения с образованием продукта (1У), который может быть превращен при избытке тг-крезола в пятиядерное соединение (V) с 90%-ным выходом:
ОН ОН ОН ОН
|
НС1 |
|
-2Н*0 |
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]()
Фенольные смолы обладают слабовыраженными кислотными свойствами [30]. Их кислотность и склонность к солеобразованию зависят как от типа используемых фенолов, так и от структуры
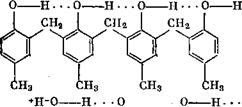
Смол. Сфиго-замещенные продукты поликонденсации обладают наибольшей кислотностью. По-видимому, благодаря именно этому они быстро отверждаются уротропином. Исследуя кривые титрования в безводных растворителях, Шпренглинт [31] установил, что у о-диоксидифенилметановых соединений с несколькими фенольными ядрами возникает концевая ОН-группа избыточной кислотности. Несимметричное распределение* заряда вызвано образованием внутримолекулярных водородных 'МОСТИКОВ, возможных только в случае яриго-замещенных:
|
|||
|
|||
|
|||
|
|||
|
|
||
![]()
Реакционноспособные тг-алкилфенольные смолы, содержащие о-диметиленэфирные и метилольные группы, тоже обладают повышенной кислотностью по сравнению с обычными фенольными смолами. У них также предполагают наличие внутримолекулярных водородных мостиков между фенольными ОН-группами и атомами кислорода в эфирных или метилольных группах [32
V
|
|
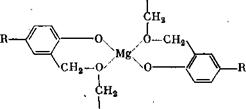
Необычно сильная способность к образованию катионных связей о-метилольными или диметиленэфирными группами может
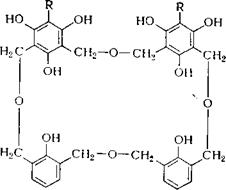
Быть объяснена с помощью теории Шпренглинга. Так как прв взаимодействии Л%0 с метилолфенолами отщепляется 1 моль Н20, то Хултч считает, что при этом протекает реакция хелатообразо - вания, при которой две молекулы смолы соединяются магниевым мостиком:
|
|
Примечательно, что у алкилфенольных смол> имеющих о, о''-дИ' метиленэфирные мостики и эфирные группы, практически каждый фенольный гидроксил связывает 1 эквивалент Ыё. Как кристаллические циклические эфиры, так и технические бутил (октил)- фенольные смолы связывают около 10% МдО, т. е. все диметилен - эфирные мостики, соединенные с фенольным гидроксилом в орт& положении, связывают 1 эквивалент Другие окислы металлов, например 2пО, взаимодействуют со смолами медленнее, чем МдО; третьи, например Ре203, А1203, вообще не взаимодействуют.
Фенольные смолы, содержащие катионы различных металлов, используются в качестве катионообменных смол, входят в состав клеев, лаков горячей сушки. Катионы могут быть введен# уже при конденсации, например в виде окислов металлов или со лев двухвалентных металлов, а также в виде алюминийорганических соединений [34], смесей металлов с сиккативами типа металле* резинатов или металлонафтенатов [35].
Зеебах [33] при конденсации фенола с формальдегидом вместо ]^0 использовал магниевую соль тетраоксиметилдиоксифенил- метана. Диспергирование свежеприготовленной гидроокиси металла в отверждаемых фенольных смолах ведёт к химическому сшиванию, благодаря чему лаки и прессовочные массы становятся особенно прочными [36]. Продукты взаимодействия окислов мат* ния и цинка с реакциодноспособными алкилфенольными смоламв используются для приготовления клеев.

 Опубликовано в
Опубликовано в