ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ПАЯНЫХ СОЕДИНЕНИИ И ИХ ЗАВИСИМОСТЬ ОТ КОМПОНЕНТОВ ПРИПОЕВ
 18 июня, 2016
18 июня, 2016  admin
admin Физические и химические свойства паяных соединений обусловлены прежде всего местом, занимаемым основой и компонентами припоя в периодической системе элементов^ принцип построении которой состоит в том, что свойства элементов определяются положением их в таблице, а свойства сочетаний элементов (сплавов)— нх взаимным расположением.
На рис. 30 представлен один из вариантов периодической системы элементов, в котором элементы-аналоги размещаются по вертикали и различаются строением внешней электронной оболочки.
|
|
|
н 13,96 |
|||||||||
|
Li |
Be |
||||||||
|
463,7 |
1660 |
||||||||
|
6,6.10" 3 |
6.10"4 |
||||||||
|
Na |
Mg |
||||||||
|
371,0 |
923,0 |
||||||||
|
2,64 |
2,1 |
||||||||
|
к |
Ca |
Sc |
Ті |
V |
Cr |
Мл |
Fe |
Co |
Ni |
|
336,4 |
1123,0 |
1803,0 |
1941,0 |
2190,0 |
2176,0 |
1617,0 |
181-1,0 |
1767,0 |
1728,0 |
|
2,6 |
3,6 |
6-Ю"4 |
6.10"1 |
1.6.10’2 |
9.10“1 |
6,1 |
3.10“3 |
8-Ю-3 |
|
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Тс |
Ru |
Rh |
Pd |
|
312,7 |
1043,0 |
177,3 |
2128,0 |
27,0 |
2890,0 |
2400,0 |
2623,0 |
2236,0 |
1827 |
|
3,1.10“2 |
4.10“3 |
2,8-10“ 3 |
2.10“ 2 |
1-Ю”3 |
8-Ю'4 |
(6-10“ 7) |
1.10“’ |
1.10“‘ |
|
|
Cs |
Ba |
La |
Hf |
Та |
w |
Re |
Os |
b |
Pt |
|
301,6 |
983,0 |
1190,0 |
2222,0 |
3270,0 |
3660,0 |
3460,0 |
3320,0 |
2720,0 |
2046 |
|
7-Ю"4 |
6-Ю"2 |
1,8.10“ 3 |
3,2.10“4 |
2-Ю-4 |
1-Ю'4 |
1.10“ 2 |
6.10“6 |
1.10“7 |
6.10“4 |
|
Fr |
Ra |
Ac |
Th |
Pa |
и |
Np |
Pu |
Am |
|
|
300,0 |
973,0 |
1323 |
1968,0 |
1873,0 |
1406,0 |
913,0 |
912,7 |
1123,0 |
|
|
Ы0-10 |
(6.10“'°) |
8-10“4 |
(1.10“'") |
3-Ю'4 |
- |
1.10“'3 |
|
Рис. 30. Периодическая система элементов с вертикальным расположением |
Относительная способность элементов к пластической деформации, их тепло - и электропроводность, а следовательно, и степень их металличности увеличиваются с увеличением порядкового номера элемента в каждой группе (по вертикали) периодической системы.
Наибольшая металличность наблюдается у элементов группы
меди, низкая — у марганца и, возможно, его аналогов. На рис. 30 для каждого элемента в числителе приведена его температура плавлення, К, в знаменателе—его содержание в земной коре, »/*.
Получение требуемых эксплуатационных свойств паяемых соединений возможно только при правильном выборе системы легирования припоя- для введения в него элементов, обеспечивающих его физико-химическую совместимость с паяемым материалом. В периодической системе существуют отдельные. группы элементов s, ds, sd, ps, характеризующиеся общностью свойств.
Щелочные металлы s-группы (Li, Na, К, Rfe, Cs) сравнительно легкоплавки; будучи введены в припои, они могут сообщать им свойства самофлюсуемости; эти металлы легко окисляются; их хлориды, фториды, бромиды, подиды входят в паяльные флюсы. Рубидий и цезий обладают высоким селективным фотоэлектриче-
|
H |
He |
||||||
|
Й |
c |
N |
О |
F |
Ne |
||
|
2348 |
4020 |
63,1 |
54,4 |
63,0 . |
24,66 |
||
|
8.10"4 |
а-ю'1) |
(ЫСГ5) |
47,2 |
2,7.10"* |
|||
|
A1 |
Si |
p |
s " |
Cl |
Ar |
||
|
833,6 |
1688 |
Kp.870 |
832,0 |
172,16 |
83.78 |
||
|
8,8 |
27,6 |
8.ІО"2 |
6-Ю-3 |
4.6.W* |
|||
|
Си |
Zn |
Ga |
Ge |
As |
Se |
Bt |
Kr |
|
1357,0 |
692,7 |
302.9 |
1210,4 |
1090,0 |
490,0 |
266,9 |
116,76 |
|
1-10"* |
В.10'3 |
ІДЛО"3 |
■a. io'4 |
- |
1.6.10"* |
4»10**S |
|
|
Ag |
Cd |
iil |
Sn |
Sb |
Те |
i |
Xe |
|
1235 |
594,3 |
.429,8 |
£06.0 |
903,9 |
723,0 |
386,8 |
161,3 |
|
ІКг’5 |
1-Ю"3 |
l-lif3 |
6.le~3 |
t4.10"5) |
(110"‘) |
З. КГ* |
|
|
Аи |
Hg 1 |
T1 |
Pb |
Bi |
Po |
At |
Rn |
|
1337.6 |
234,3 |
677,0 |
600 . |
544,8 |
627,0 |
676,0 |
202,2 |
|
6-Ю'7 |
7-1 О*4 |
(2-Ю-4) |
1 ,e. nr2 |
(2.ІСГ3) |
2.10"14 |
||
|
элементов-аналогов |
ским эффектом — испускают электроны под действием света. Металлические рубидий и цезий могут работать в вакууме как геттеры [64].
В tfs-групне щелочноземельных металлов бериллий обладает особыми свойствами; малой величиной захвата тепловых нейтронов и относительно высоким эффектом’' рассеяния, высокой проницаемостью рентгеновских лучей (в 17 раз выше, чем алюминии), хоро
шим распространением звука (в 2,5 раза выше, чем сталь), малой плотностью, высокими удельной жесткостью, хладноломкостью и прочностью. Бериллий стоек в воде и расплавленной щелочи, имеет высокую упругость н коррозионную стойкость (как у титана).
Бериллий как легирующий элемент способствует старению сплавов меди, сопровождающемуся упрочнением, повышает теплопроводность, обеспечивает устойчивость против усталости н ударных нагрузок, хладостойкость, электропроводность, высокую коррозионную стойкость, близкую к коррозионной стойкости нержавеющей стали, высокую прочность и упругость, аналогичную для высокопрочных легированных сталей.
В сплавах алюминия бериллий резко повышает механические свойства, жаропрочность, жидкотекучесть, измельчает зерно, резко уменьшает закаляемость окисляемость алюминиевых н магниевых сплавов.
В сталях бериллий сохраняет компенсирующие термоупругне свойства, обеспечивает малый нли нулевой КЛР, хорошую устойчивость против коррозии.
К благородным металлам ds-группы относятся золото, серебро и металлы платиновой группы — платина, палладий, иридий, осмий, рубидий, рутений. Платина, золото и серебро имеют малую твердость и высокую пластичность, а также электропроводность (больше, чем у меди). Все благородные металлы немагнитны. Особенность платины состоит в том, что ее КТР близок к КТР стекла и фарфора. Палладий более химически активен, чем платина. Электросопротивление благородных металлов убывает в следующем порядке: Pt-»-Pd-»-Ir-»-Rh-»-Au—>-Ag.
Все благородные металлы, кроме рения, весьма устойчивы в серной, соляной, фосфорной, фтористой и уксусной кислотах [65].
Среди sd-элементов металлы группы цинка (кадмий, ртуть) характеризуются высокими значениями давления насыщенного пара, возрастающими вместе с ростом легкоплавкости н атомной массы. Цинк относительно малопластичен, ps-металлы группы алюминия (галлий, индий, таллий) имеют высокую пластичность, низкую температуру плавления, малую прочность. От галлия к таллню, температура плавления повышается, а температура кипения понижается. Все эти металлы имеют сравнительно малую теплоту образования окислов.
Индий и таллий обладают высокой стойкостью в щелочах; индий не тускнеет на воздухе, по галлий и таллий на воздухе быстро окисляются с образованием слоя окислов (Ga2Os и ТЬО), замедляющих дальнейшее окисление этих металлов. Индий также относительно стоек во фтористой кислоте при 20 °С, а таллий — в соляной кислоте.
Галлий и таллий хорошо смачивают металлы и неметаллы — кварц (>1150°С), алунд (>1000°С), графит (>800СС), стекло пирекс (>500 °С).
Все эти металлы вследствие их легкоплавкости и особенностей свойств нашли применение в качестве компонентов припоев.
Возрастание металличностн в Каждой группе периодической системы по мере увеличения атомной массы элементов обусловливает существование среди элементов на границе металлов и неметаллов таких,. одна из модификаций которых имеет характерные свойства металлов, а другая — неметаллов (олово и висмут). Подобный полиморфизм у олова наблюдается с изменением темпе
ратуры и (или) давления. Белое р-олово (металлическая модификация имеет плотность 7,28 гс/м3) переходит в серое а-олово (плотность 5,82 г/см3) при температурах ниже 13,2 °С. Это превращение сопровождается большим изменением объема металла, что вызывает его разрушение Н превращение в серый порошок («оловянная чума»); скорость p-нг-превращения при 13,2 °С очень мала и достигает максимума лишь при —3(Н—50°С, а с дальнейшим понижением температуры снова уменьшается.
В олове р—а-превращению способствуют зародыши серого олова, напряженное состояние в олове, повторные нагревы и охлаждения, а также легирование олова алюминием, цинком, германием, медью, железом, кобальтом, марганцем, магнием. Это превращение задерживается при введении в олово висмута, сурьмы, свинца, кадмия, серебра, индия, золота и никеля. При содержании в олове 0,3—0,5% Bi, или 0,5% Sb, или 1% РЬ р-их-превращение при низких температурах становится невозможным. Поэтому для пайки деталей, работающих при пониженных температурах, применяют не чистое олово, а его технические марки.
При 20°С висмут почти диэлектрик с ромбической структурой. Полиморфизм висмута при '20°С проявляется только при повышении давления. Превращение Віі->-Віп с моноклинной структурой происходит при давлении 2,5 ГПа, превращение Він-*-Віт со структурой
г. п. у. происходит при 2,7 ГПа, превращение Biin-»-Biiv со структурой о. ц. к. имеет место при 4 ГПа, а превращение Biiv-»Biv со структурой о. ц. к.— при 7,75 ГПа. Все модификации висмута обладают высокими значениями электросопротивления, плотности, модуля упругости и коэффициента Пауссона. Висмут из неметаллического переходит в металлическое состояние. При давлении —100 кПа висмут обладает сверхпроводимостью (Гк=6KJ, при затвердевании он расширяется.
Другим легкоплавким металлом, расположенным вблизи границы с областью неметаллов и имеющим полиморфное превращение (при 300°С и давлении—16 ГПа), является свинец. Важнейшие особенности свинца следующие: отсутствие хладноломкости, повышение прочности и пластичности с понижением температуры, низкая температура рекристаллизации (ниже комнатной), что приводит к невозможности упрочнения его наклепом, пониженная коррозионная стойкость.
Важным параметром припоев и их компонентов является степень упругости испарения. Очень высокой упругостью испарения среди металлов обладают, кроме цинка, кадмия и ртути, также марганец, магний и литий, а среди неметаллов — мышьяк н сурьма. Неметаллы бор, углерод, кремний, фосфор, сера, германий, мышьяк, сурьма — важнейшие депрессанты припоев, а неметаллы фтор, хлор, бром, иод — основные составляющие компонентов паяльных флюсов.
Ниже приведены важнейшие физические и химические свойства элементов [64—66], введение которых позволяет во многих случаях обеспечить специфические свойства припоев:
![]() Свойство
Свойство
Особая легкоплавкость Хорошая смачиваемость, в том числе не металлов
Свойство
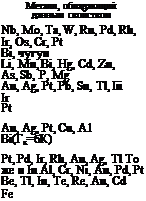
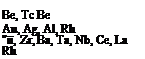 Повышенная тугоплавкость и прочность
Повышенная тугоплавкость и прочность
Расширение при затвердевании Высокая упругость испарения при давлении -—100 кПа и низком вакууме Особо высокая пластичность Особо высокая износостойкость Малая разница КТР металла со стеклом, керамикой, фарфором Высокая теплопроводность Сверхпроводимость Стойкость:
в кислотах НС1, H2S04, Н3РО4 уксусной и ледяной при давлении ~ 100 кПа в щелочи в парах ртути
Высокие фотоэлектрические свойства Хорошее распространение звука Хорошая проницаемость рентгеновских лучей
Малая величина захвата тепловых нейтронов
Высокий эффект рассеяния электронов Высокая отражательная способность Геттерные
Неокисляемость при высоких температурах
 Опубликовано в Проектирование технологии пайки металлических изделий
Опубликовано в Проектирование технологии пайки металлических изделий Комментарии закрыты.
