М-КСИЛОЛ
 15 августа, 2013
15 августа, 2013  admin
admin 41:
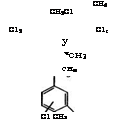
Основные промышленные и перспективные направления использования ж-ксилола представлены на схеме (рис. 13).
Большая часть ж-ксилола изомеризуется в я - и о-ксилолы, масштабы промышленного применения которых значительно выше, чем ж-изомера. Содержание ж-ксилола во фракциях С8 катализата риформинга и пироконденсата составляет 35-45 и 25-30 % (мае.) соответственно. После выделения основного количества о-ксилола ректификацией и я-ксилола адсорбцией на цеолитах или кристаллизацией остающийся концентрат ж-кси - лола изомеризуют на цеолитсодержащих катализаторах [281].
Термодинамическое равновесие при изомеризации ксилолов и термодинамические свойства ж-ксилола рассмотрены в обзоре [282].
Продолжается поиск более активных катализаторов изомеризации ж-ксилола и этилбензола, обеспечивающих повышенную селективность образования я-ксилола. Так, фирма «Mobil Oil Corp.» запатентовала изомеризацию аренов С8 над цеолитом ZSM-22, содержащим 0.005-5 % (мае.) Pt или Pd. При мольном соотношении Н2 : сырье = 4 : 1, температуре процесса 470°С, давлении 1.36 МПа и содержании ж-ксилола и этилбензола в сырье
50.6 и 19.7 % (мае.) концентрация я-ксилола возрастает с 9.5 до
18.3 % (мае.) в изомеризате [283].
Фирма «UOP» рекомендует использовать для изомеризации смеси ксилолов и этилбензола цеолит Q состава aM2/„/Al203/bSi02, где а = 0-1.2, М - катион с валентностью я, b > 7. Катализатор нанесен на пористый неорганический носитель и содержит Pd или Pt в качестве промотора [284].
Промышленное применение катализатора изомеризации ксилолов, содержащего 0.38 % (мае.) Pt на ДT203 и цеолит ZSM - 5, позволило повысить выход я - и о-ксилолов на 30 % [285].
При использовании для изомеризации аренов С8 сверхвысококремнеземного цеолита конверсия этилбензола при 365 °С достигает 43.6 % [286]. Повышенная конверсия этилбензола отмечается и в присутствии нецеолитного молекулярного сита типа Mg-APSO, содержащего MgOf, А102, Р02 и Si02 в микропористой
СН3 СН3
![]()
|
Сн3 |
![]() } + Сн3
} + Сн3
СН3
|
СНз
|
Н3С СН3 СООН СОС1
|
БОСЬ |
![]()
![]() Полиэфирные смолы
Полиэфирные смолы
|
|
--- ► полиамиды
СООН
|
Ныо2 Н2804 |
|
Сн3 1ч н ЧСН, |
|
СН3 СНз |
|
N0, |
|
СС13 |
|
СН2С1 3 СС13 С1^ СН2С1 |
|
Сн. |
|
СНЯ 02N Ш2 |
|
Ньго3 |
|
Н2804 |
|
СНз N02 CN CH2NH2 |
|
Мн9 |
|
СН2=СНСН3 |
|
Ш СНгИН2 СН(СН3)2 он СНз 1 СНз |
|
СН3 |
|
СН2С1 С12 С1: |
|
У Чсн3 Сня |
|
С1 СНз |
|
N0, |
|
Сн. |
|
РШо |
|
Сн. |
|
||
|
||
|
||
 |
||
|
||
|
||
 |
||
 |
||
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рис. 13. Направления использования м-ксилола 264
Кристаллической решетке, а также металл подгруппы Р1 и неорганический оксид в качестве связующего [287].
Высокая конверсия этилбензола при гидроизомеризации 60 % и селективность образования ксилолов свыше 40 % установлена для катализатора Р1;/А1203-Са-морденит [288].
Высокая селективность образования я-ксилола при изомеризации ксилолов при 300-445 °С проявляется на боралюмосили - катных катализаторах со структурой г8М-5, синтезированных в нещелочных средах и проявляющих молекулярноситовой эффект [289].
Изомеризация л*-ксилола изучена на молекулярных ситах типа А1Р04-5 и 8АРО-5 при 350-500°С. Установлено, что лучшие результаты достигаются в присутствии вАРО-б: конверсия лг-кси - лола 45.8 %, суммарная селективность превращения в я - и о-кси - лолы - свыше 63 % [290].
Энергии активации и теплоты адсорбции при изомеризации ксилолов заметно снижаются при повышении силикатного модуля пентасилов 8Ю2/А1203 от 55 до 111. Коэффициенты диффузии ксилолов снижаются, а энергии активации диффузии мало изменяются при увеличении силикатного модуля [291].
При изомеризации ксилолов в качестве катализаторов могут использоваться активные водородные формы природных цеолитов, частично смешанные с различными неорганическими матрицами (А1203, глинами, алюмосиликатами), содержащие Р1 или Рс1. Установлена высокая активность катализаторов на основе клиноптилолита и шабазита, что достигается взаимодействием природных цеолитов с А1203 и активной формой высококремнеземного цеолита, взятых в соотношении 50 : 30 : 20 % (мае.) [292].
Удаление примесей насыщенных, непредельных углеводородов, бензола и толуола, образующихся при изомеризации ксилолов, может осуществляться в совмещенном процессе с азеотроп - ной ректификацией с метанолом [293].
Ж-Ксилол можно трансформировать в триметилбензолы и толуол по реакции диспропорционирования. Соответствующие превращения лг-ксилола исследовались на глинах - бейделлите и монтмориллоните, модифицированных оксисоединениями А1, а также на ультрастабильном цеолите У. При использовании последнего катализатора при 350 °С достигаются максимальные активность и селективность: конверсия л*-ксилола 73.3 %, выход толуола 19.75%, выход триметилбензолов 30.65% при доле псевдокумола около 65 % [294].
Жидкофазным каталитическим окислением лг-ксилола в уксуснокислой среде производится в промышленности изофталевая кислота [43]. Б качестве катализатора используются ацетаты ио и Мп, промотированные солями Вг (фирма «Ашосо»), или ацетат Со с ацетальдегидом как активатором (фирма «SISAS»). Расходные коэффициенты и удельные энергозатраты на 1 т изофтале - вой кислоты в процессе «SISAS»: ж-ксилол - 0.678 т, ацетальде - гид - 0.165 т, воздух (Р = 1.5 МПа) - 3100 м3, (СН3СОО)2Со • 4НгО - 2 кг, электроэнергия - 190 кВт ч, охлаждающая вода - 400 м3.
Окисление ж-ксилола или ж-толуиловой кислоты можно также проводить концентрированной HN03 при 200 °С и давлении 4 МПа.
Способы получения высокочистой изофталевой кислоты жидкофазным окислением воздухом запатентованы японской фирмой «Mitsubishi Gas Chemical Со.». В присутствии ацетатов Со и Мп, а также НВг в среде уксусной кислоты с выходом 93 % получают изофталевую кислоту, содержащую 1500 ррт 3-карбо - ксибензальдегида. Неочищенный продукт обрабатывают в среде уксусной кислоты, содержащей 10 % (мае.) воды, при 230°С и давлении водорода 3 МПа в присутствии 0.5 % (мае.) Pt, нанесенной на активированный уголь. В результате получается изо - фталевая кислота с выходом на стадии очистки 95.8 %, содержащая 30 ррт 3-карбоксибензальдегида, большая часть которого переходит в ж-толуиловую кислоту, которая лучше растворима в уксусной кислоте [295, 296].
Та же фирма для получения высокочистой изофталевой кислоты предложила проводить окисление ж-ксилола в 85-97 %-й уксусной кислоте в присутствии того же катализатора (Со, Мп, Вг ) в две стадии - сначала при 180-210°С, затем при температуре, сниженной на 30°С [297].
ОАО « Алтайхимпром » запатентовал способ получения высокочистой изофталевой кислоты, при котором в состав обычного для этого процесса катализатора дополнительно вводят LiCl или его смесь с хлорсодержащим соединением ХС1П, где X = Мп, Со, H; п = 1, 2, при соотношении Cl:Br= 1.1-1.9. Ступенчатое окисление ж-ксилола проводится при 189-197°С в течение 35-45 мин, затем техническая изофталевая кислота перекристаллизовыва - ется в уксусной кислоте, содержащей 5-12 % (мае.) воды [298].
Изофталевая кислота используется для производства ненасыщенных полиэфирных смол. Взаимодействием изофталевой кислоты с SOCl2 и СОС12 в присутствии вторичных аминов или СН3СОС1 при 130°С получают изофталоилхлорид. Изофталоил- хлорид производится также гидролизом гексахлор-ж-ксилола водой при 95-100 °С в присутствии катализатора - FeCl3. Поликонденсацией изофталоилхлорида с бисфенолом А получают термопластичные полиарилаты [299].
Поликонденсацией изофталоилхлорида с диаминами получают термостойкие ароматические полиамиды, применяющиеся для производства полиамидных волокон, полимерных пленок и пластических масс [300].
Диаллилизофталат используется в качестве сшивающего агента для полиэфирных смол. Диметил-, диэтил - и ди(2-этилгек - сил)изофталаты применяются как пластификаторы.
Нитрованием ж-ксилола получают смесь 2,4- и 2,6-диметил- нитробензолов с небольшими примесями других изомеров, которые разделяют вакуумной ректификацией [301]. Восстановлением нитропроизводных ж-ксилола чугунными стружками или водородом в паровой фазе в присутствии Си-М-катализатора при 200°С и давлении 0.8-1.0 МПа производятся ж-ксилидины. 2,4- ж-Ксилидин применяется в производстве азокрасителей и пигментов, 2,6-ж-ксилидин - в синтезе пестицидов.
Нитрованием ж-ксилола смесью НМ03 и Н2804 с выходом 80 % получают 2,4,6-тринитро-ж-ксилол, который в качестве взрывчатого вещества применялся в сплавах с тротилом для снаряжения боеприпасов.
Окислительным аммонолизом ж-ксилола в присутствии катализаторов - У205 или ]ЧН4У03 и Ав203 - при 380 °С получают изофталодинитрил и последующим гидрированием - ж-ксили- лендиамин. Те же продукты могут быть получены взаимодействием изофталевой кислоты с аммиаком [302]. Изофталодинитрил применяется в производстве фунгицидов и гуанаминовых смол. ж-Ксилилендиамин используется в синтезе красителей и лекарственных веществ.
При алкилировании ж-ксилола пропиленом образуется 1-изо- пропил-2,4-диметилбензол, из которого получают 2,4-ксиленол, применяемый в качестве растворителя, а также в производстве пластмасс, ядохимикатов, фармацевтических препаратов [303].
Фотохимическим хлорированием ж-ксилола или в присутствии 2,2/-азо-бис-изобутиронитрила получают ж-ксилилхлорид, ж-ксилилендихлорид и гексахлор-ж-ксилол. При жидкофазном хлорировании ж-ксилола при 50-70°С в присутствии ЕеС13 образуются монохлорксилолы с атомом хлора в ароматическом ядре [94].

 Опубликовано в
Опубликовано в