РЕАКТИВНО-ФЛЮСОВАЯ ПАЙКА
 13 марта, 2016
13 марта, 2016  admin
admin Пайку, при которой припой или слой жидкой полуды образуются в результате восстановления металлов из компонентов флюса, называют реактивно-флюсовой. Восстановление металла из компонентов флюса может происходить в результате диссоциации солей при нагреве или при вытеснении из них металлов при взаимодействии с паяемым материалом.
Реактивно-флюсовую пайку можно проводить с флюсом, содержащим легко диссоциирующие химические соединения. Нелетучие металлические компоненты таких соединений, иногда в сочетании с другими металлами, служат припоями. Летучие
компоненты флюсов могут создавать среду, защищающую паяемый шов от окисления.
Восстановленные из флюса прослойки жидких металлов активируют поверхность паяемого материала и служат компонентами припоя. Летучие продукты взаимодействия могут создавать газовую среду, защищающую паяемый металл от окисления или восстанавливающую его оксиды. Необходимыми компонентами реактивных флюсов являются галогениды металлов.
Возможность протекания реакции восстановления металла из солей флюса на поверхности паяемого металла при погружении его в водный раствор или неводный раствор или в солевой расплав определяется активностью металлов для этих условий. Сравнительная активность металлов для этих условий. Сравнительная активность металлов представляется так называемым рядом напряжений. Ниже представлены такие ряды напряжений металлов для хлоридов, бромидов, иодидов и их водных растворов.
Для водных растворов галогенидов ряд имеет вид: Li, К, Rb, Са, Na, La, Nd, Mg, Be, Al, Zr, Mn, Nb, Zn, Cr, Ga, Fe, Cd, In, Co, Ni, Mo, Sn, Pb, H, Cu, Hg, Ag, Pd, Pt, Au.
Для расплавов галогенидов ряд напряжений существенно зависит от природы и состава растворителя и температуры. Так, по Л. Л. Антипкину и Ю. К. Делимарскому, электрохимический ряд для расплава NaF имеет вид: Na, Mn, Zn, Al, Cd, Fe, Pb, Co, Ni, Bi, Zr, Cr; расплава NaCl — Ba, Cr, K, Li, Na, Ca, Mg, Be, Mn, Al, Zn, Cd, Pb, Sn, Ni; для смеси NaCl, KC1 и SrCl — Na, Be, Mn, Al, Zn, Cd, Pb, Sn, Cu, Co, Ni, Ag, Hg, Bi, а для расплава — NaON — Na, Zn, Sb, Cd, Pb, Bi.
В таком ряду напряжений каждый металл способен вытеснять из солей другие металлы, расположенные правее него.
Температура начала самопроизвольного процесса восстановления металлов из галогенидов в контакте с паяемым металлом определяется изменением знака изобарного потенциала с ( + ) на (-)■
Чтобы вытесненный из соли металл мог стать припоем, температура плавления его должна быть ниже температуры пайки. Только при этом условии вытесненный металл может смачивать паяемый металл, контактно расплавлять его под слоем оксидной пленки, проникая через несплошности в ней, и диспергировать ее и, таким образом, активизировать действие флюса, облегчать растекание готового припоя по поверхности паяемого металла и затекание его в зазор.
На примере алюминиевых сплавов показано [15], что процессы взаимодействия паяемого материала с компонентами реактивных флюсов могут протекать с выделением теплоты, и эта теплота в условиях погружения в расплав галогенидов МеГ может быть использована для пайки и даже сварки. При этом происходит экзотермическая реакция
Me (т)+МеТ (ж)^РЛеГ (г) + Ме' (т) +Q.
Для определения нижней границы температурного интервала активности расплава галогенидов необходимо знать температуру начала самопроизвольной реакции, что определяется по изменению изобарного потенциала реакции в зависимости от температуры. Реакция алюминия с галогенидом олова, цинка, кадмия, свинца и висмута при температуре выше температуры плавления восстановленного металла имеет вид
2А12 (г) +яМеГ(—-) (ж) 2А12Г3(г) +/гМе (ае),
где Г — галогены С1, Вг.
Для Bi коэффициент п = 3; для Zn, Pb, Cd п = 2.
Приближенный расчет изобарного потенциала для соответствующей реакции проводят по уравнению
AG°T= -4,575 [(ДМ/Г) + ДА], (11)
где М = — А Н298/4,575 и N = А $298/4,575.
Поскольку самопроизвольное течение процесса восстановления металлов из галогенов определяется изменением знака изобарного потенциала AG°T и учитывая, что его значение для фазового перехода А1(г)->А1(лс) составляет 10,38 Дж/моль, по уравнению (11) находим, что такое значение A GT достигается для различных галогенидов при температурах: 450 К для CdCl2 и РЬС12; 470 К для ZnCl2 и SnCl2; 500 К для ВіС12; 700 К для BiBr2;> 700 К для РЬВг2.
На основании этого можно заключить, что расплавление алюминия при погружении его в расплав соответствующих галогенидов (при достаточно большом объеме последнего) может наступить при указанных выше температурах.
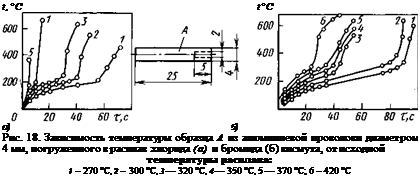 |
Исследования [15] показали, что после достижения расплавами галогенидов BiBr3 и ВіС13 температуры самопроизвольного течения реакции восстановления висмута при погружении в них образцов из скруток алюминиевых проводов ПЭВА диаметром 4 и длиной 150 мм температура в их торце, погруженном в галогенид, начинает быстро подниматься (рис. 18). При более высоких температурах расплава нагрев происходит по всей погруженной
поверхности образца. Время до начала подъема температуры образца зависит от температуры галогенидной ванны. Процесс экзотермической реакции развивается весьма быстро (рис. 19).
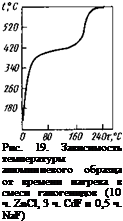 На торце скрутки проводов, начиная с некоторой температуры, при достаточной выдержке и подъеме температуры до температуры автономного расплавления алюминия, процесс может происходить бурно, с оплавлением металла и выбросом галогенида из ванны, по-видимому, под действием газообразных продуктов реакции [15].
На торце скрутки проводов, начиная с некоторой температуры, при достаточной выдержке и подъеме температуры до температуры автономного расплавления алюминия, процесс может происходить бурно, с оплавлением металла и выбросом галогенида из ванны, по-видимому, под действием газообразных продуктов реакции [15].
В процессе экзотермического нагрева алюминиевых образцов температура расплава галогенида по сравнению с его исходной температурой изменяется мало.
При погружении проводов в расплав галогенидов при температуре выше температуры начала самопроизвольного экзотермического нагрева образца характерно развитие интенсивной эрозии паяемого металла, прежде всего по выступам деталей, в результате чего, например, пруток прямоугольного или квадратного сечения очень быстро приобретает соответственно овальное или круглое сечение, что ограничивает применение способа пайки нагревом в расплавах галогенидов деталями с формой тел вращения. Во флюсах, содержащих галогениды металлов в ограниченных количествах, экзотермический эффект должен быть выражен слабее.
При пайке с ограниченным объемом флюса или с флюсом, содержащим кроме галогенидов металлов, восстанавливаемых в контакте с паяемым металлом, также и соли металлов, не восстанавливаемых в этих условиях, эффект экзотермического нагрева проявляется намного слабее. Реактивно-флюсовая пайка получила наибольшее распространение для алюминия, а в последнее время также для меди, медных сплавов и сталей в связи с повышенной активностью реактивных флюсов.
 Опубликовано в Пайка металлов
Опубликовано в Пайка металлов Комментарии закрыты.
