ПОЛУЧЕНИЕ РЕАГЕНТОВ ИЗ ХИМИЧЕСКИХ СОЕДИНЕНИИ
 24 декабря, 2016
24 декабря, 2016  Mihail Maikl
Mihail Maikl 8.2.1. Получение водорода диссоциацией аммиака
Аммиак имеет высокое содержание водорода — 0,176 кг на 1 кг NH3. Промышленное производство аммиака составляет миллионы тонн в год при относительно невысокой стоимости (около 100 руб за тонну). Состав жидкого синтетического аммиака регламентирован и позволяет осуществлять его диссоциацию без предварительной очистки, а продукты диссоциации направлять непосредственно в ЭХ Г.
Система хранения жидкого аммиака является менее металло - емкой, чем СХПР сжатого водорода (баллон жидкого аммиака эквивалентен восьми баллонам сжатого водорода), и более удобной для транспортировки. Соотношение массы тары к массе водорода в аммиаке составляет 10:1, в то время как для баллонного водорода оно составляет 100:1. Ввиду низкого давления насыщенных паров аммиак весьма удобно хранить и транспортировать обычными видами транспорта.
Давление насыщенных паров аммиака:
Температура, °С... . —50 —30 0 +20 +50 +70
Давление, МПа.... 0,039 0,117 0,423 0,845 2,01 3,38
Впервые реакция разложения аммиака в присутствии железа была открыта в начале XIX в. Впоследствии значительное внимание было уделено реакции синтеза аммиака из-за ее большого значения в проблеме связывания атмосферного азота, а реакция диссоциации аммиака была изучена гораздо меньше.
Разложение аммиака начинается при 270°С, а при температуре свыше 900°С аммиак практически разлагается полностью. Реакция диссоциации протекает с поглощением теплоты и идет по уравнению
2NH3 N2 + ЗН2 — 92 кДж.
Полнота реакции диссоциации аммиака зависит от температуры, давления и типа катализатора.
Зависимость константы равновесия реакции диссоциации аммиака от температуры выражается уравнением
— 4780
lgXp= —j— + 3,52 lg 7-+ 0,8.
С ростом температуры степень диссоциации аммиака возрастает. Влияние температуры на степень диссоциации аммиака приведено в табл. 8.3.
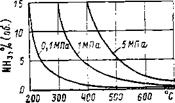
Влияние давления при различных температурах на равновесное содержание аммиака приведено на рис. 8.2.
 |
Для проведения процесса диссоциации аммиака с большой степенью разложения при значительных расходах до 0,6 м3-с-1 наиболее пригодны железные промотированные катализаторы синтеза аммиака, показывающие высокую активность прн 400—600 °С. Из них наиболее активны и термостойки катализаторы марок ТК и СА; разложение аммиака на них идет с заметной скоростью уже при
|
Рис. 8.2. Равновесные концентрации аммиака в зависимости от давления при различных температурах. |
 .Рис. 8.3. Схема диссоциатора аммиа-
.Рис. 8.3. Схема диссоциатора аммиа-
ка с газовым обогревом.
400°С. Следует отметить, однако, что ни один из промышленных катализаторов, применяемых в процессе синтеза аммиака, не является оптимальным для процесса диссоциации [8.1].
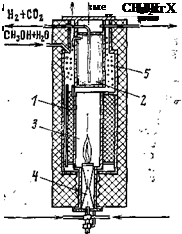
На рис. 8.3 приведена наиболее простая конструкция диссоциатора, обогреваемого продуктами горения диссоциированного аммиака.
Горелка 1 дает диффузионный факел, что позволяет осуществить более или менее равномерный подвод тепла к кольцевому пространству, заполненному в самой горячей, нижней части инертной насадкой 2. Выше нее расположен катализатор диссоциации 3.
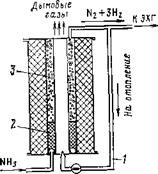
Компактный диссоциатор, разработанный в Институте газа АН УССР (рис. 8.4), работает следующим образом. Газообразный аммиак перегревается в змеевике 3 и направляется в коллекторы двух катализаторных коробок 2, заполненных катализатором ГК-1. Внизу расположена кольцевая диффузионная горелка 1, работающая на диссоциированном газе.
![]() Экономичность работы диссоциатора характеризует термический КПД
Экономичность работы диссоциатора характеризует термический КПД
'4t = Qnj/Qn
где — теплота сгорания полученного чистого водорода; Qr — теплота сгорания затраченного исходного горючего.
При наиболее благоприятных режимах работы максимальный КПД достигает 70%.
 |
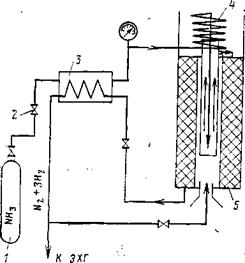
Принципиальная схема получения водорода диссоциацией аммиака представлена на рис. 8.5.
Аммиак из баллона 1 через вентиль 2 поступает в испаритель - утилизатор тепла 3, затем в перегреватель 4 и далее в диссоциа - тор 5, где на катализаторе при 550—600°С происходит разложение аммиака на азотно-водородную смесь. После диссоциатора азотноводородная смесь разделяется на два потока — один на горелку для отопления, другой к ЭХГ.
8.2.2. Получение водорода конверсией метанола
Метанол (СН3ОН)| в обычных условиях представляет собой бесцветную прозрачную жидкость с запахом, подобным запаху этило-
-вого спирта. Ядовит, поэтому предельно допустимая концентрация метанола в воздухе производственных помещений 50 мг/м3. Метанол имеет достаточно высокое содержание водорода — 0,125 кг на 1 кг СНзОН. Промышленное производство метанола составляет миллионы тонн в год. Транспортировка и хранение метанола не требуют особых условий, однако должны соблюдаться соответствующие правила хранения и обращении. Отечественная промышленность производит метанол различного качества в зависимости от содержании примесей. Так, одна из модификаций метанола содержит
|
Рис. 8.5. Принципиальная схема получении водорода диссоциацией аммиака. |
серы не более 0,002, железа не более 0,01, альдегидов и кетонов не более 0,07% и пригодна для получении водорода без предварительной очистки. Цена метанола около 100 руб за тонну. Технологический процесс — одноступенчатая паровая каталитическая конверсия; при этом выход водорода составляет 0,185 кг на 1 кг СН3ОН. На катализаторе при 200—400°С метанол разлагается по следующей реакции:
СН3ОН ЇІ СО + 2Н2 — 90 кДж. (8.1)
В случае разложения водного раствора метанола одновременно идет также реакции конверсии СО водяным паром
С0 + Нг0^С02 + Н2-)-41 кДж. (8.2)
Изменением концентрации метанола в исходном растворе можно получить конвертированный газ с любым соотношением СО/С02. В том случае, когда целевым продуктом реакции является водород, целесообразно перерабатывать именно водный раствор метанола: концентрация водорода получается больше, а расход теплоты на единицу образующегося водорода на 31,8% меньше (с учетом теплоты испарения исходных веществ).
Таким образом, суммарная реакция
СН3ОН + Н20 ^ С02 + ЗН2 — 49 кДж (8.3)
эндотсрмична и для осуществления ее требуется подвод теплоты извне.
Для вычисления константы равновесия реакции (8.3) можно пользоваться уравнением
9917
lg Кр= ZZfJ~ + 0,297 lg Г + 0,3529-10-3Г— 0,0508-10-«Г2—3,26.
Реакция (8.1) является обратной реакцией синтеза метанола, который подробно исследован и широко применяется в промышленности. В результате каталитического процесса конверсии образуется газовая смесь, состоящая в основном из водорода, углекислого газа и окиси углерода. Так как эти примеси недопустимы Для ЭХГ со щелочным электролитом, необходима стадия очистки водорода. Параметры процесса конверсии метанола в системе подготовки топлива для ЭХГ со щелочным электролитом составляют по давлению до 10 МПа и по температуре 200—400°С. При этом давление определяется характером процесса последующей очистки конвертированного газа, а температура — активностью современных катализаторов. Если принять допущение о том, что реакционная смесь идеальна, т. е. подчиняется уравнениям состояния идеального газа, то равновесный состав смеси может быть рассчитан сравнительно просто. При этом методика расчета состоит в следующем. Расчетное уравнение реакции на 1 моль прореагировавшего метанола можно записать в виде
О + °0 (1 + Мсн, ои) = МНг + МСОг + Mqq + + Л'/СНз0Н,
где AJi -— число молей соответствующих компонентов; а — мольное соотношение вода : метанол в исходной смеси.
Указанная система пяти уравнений, приведеннаи к виду, удобному для практического использования, имеет вид t
уИНг = 2 + Мс0;
^СОг= 1 —0>
Г. , , .
.. jVfCH, OH [3 + а + (я + 1) - WCHj0H]2 _
; со_ vh
,, мн, мс о,.
■ ■ Л1н8о - KfMco ’ 9
мн, о + ^соа — а
^СН^ЗН — а ’ •
где Kh, Kh — коэффициенты летучестей чистого вещ£с£в& в иета - нола.
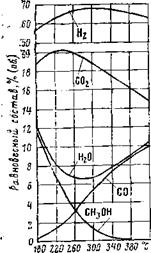
На рис. 8.6 показаны изменения концентраций всех компонентов конвертированного газа в зависимости от температуры при постоянных давлении и соотношении вода : метанол в исходном растворе.
 |
 |
Сравнение характера изменения концентраций говорит о следующем. Равновесное количество метанола падает с температурой, вызывая рост концентрации водорода. Концентрация СО непрерывно растет, что объясняется смещением равновесия реакции водяної о газа в сторону исходных продуктов (СО и HjO). Это смещение таково, что вызывает даже некоторое падение концентрации водорода и заметное снижение концентрации СОг, несмотря на увеличивающуюся степень конверсии. Содержание водяного пара во влажном
Рис. 8.6. Равновесный состав Рис, 8.7. Схема метанольиого конвертированного газа при генератора водорода с газовым р=4 МПа и а=1. обогревом.
газе имеет ярко выраженный минимум в том месте, где степень конверсии уже высока, а влияние реакции водяного газа еще не начало сказываться. Данная картина является характерной и наблюдается также при любых других расчетных давлениях.
Для паровой конверсии метанола важной характеристикой является содержание окиси углерода в конвертированном газе. Наличие <Ю в газе свидетельствует о неполноте реакции конверсии. С точки зрения максимального использования топлива наличие как СО, так и СН3ОН в конвертированном газе нежелательно. В связи с этим 'оптимальные режимы работы лежат там, где степень конверсии высока, но не настолько, чтобы выход водорода уменьшался за счет образования окиси углерода.
Условия проведения процесса конверсии метанола и требования к степени его совершенства зависят от выбранной системы очистки
водорода. При поглотительных (сорбционных) системах очистки практически весь водород, содержащийся в продуктах конверсии, поступает к потребителю. Конверсия и термическая регенерация поглотителя (если она имеется) осуществляются за счет сжигания в топке необходимого количества исходного топлива. При диффузионной очистке газа на палладиево-серебряном отделителе водорода теплота для конверсии получается при сжигании остаточного газа, не прошедшего через мембраны отделителя.
Для ЭХГ с кислым электролитом наличие СО и СОг не критично, и процесс конверсии может вестись на существенно низкие параметры.
Из-за отсутствия специальных катализаторов конверсии метанола в процессе могут быть использованы промышленные катализаторы синтеза этого продукта, а также низкотемпературные катализаторы конверсии окиси углерода, основными компонентами которых являются медь, цинк, хром. Катализаторы этого типа (марки НТК) представляют особый интерес, так как являются низкотемпературными и обеспечивают получение конвертированного газа с минимальным содержанием окиси углерода, что имеет существенное значение при любых методах газоочистки. Исследованиями установлено, что высокая каталитическая активность этих катализаторов обусловлена наличием в них меди. Такие катализаторы активны при 200—300°С, давлении до 15 МПа и расходе 0,08—0,8 м3/с.
При конверсии окиси углерода ее остаточное содержание в газе достигает 0,3% (об.) и менее. Допустимая концентрация сернистых соединений в газе, поступающем на катализатор, составляет 0,1— ■1 мг, м3. Срок службы катализатора в промышленности более двух лет.
Компактный метанольный генератор водорода, работающий под давлением до 2 МПа, показан на рис. 8.7. Сырьем для него служит стехиометрический водный раствор метанола, а также неразбавленный метанол (для обогрева генератора во время пуска). Раствор метанола подается в верхнюю часть генератора в пароперегреватель 5 и распределяется в реакторе 1, заполненном цинк-хром-мед - ным катализатором НТК-2. Обогрев топочной камеры 3 производится с помощью комбинированной газожидкостной инжекционной горелки 4. Очистка водорода происходит в диффузионном отделителе водорода 2 трубчатой конструкции на основе сплава Pd—Ag.
Коэффициент полезного действия генератора водорода определяется как отношение теплоты сгорания полученного чистого водорода к теплоте сгорания израсходованного метанола:
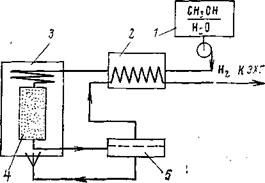
Принципиальная схема получения водорода конверсией метанола представлена на рис. 8.8.
Водный раствор метанола из емкости 1 подается на подогрев н испарение в теплообменник 2 и далее в пароперегреватель 3. Из пароперегревателя перегретый пар поступает в конверсионные камеры реактора 4, где на катализаторе при 250—300СС осуществляется процесс паровой конверсии с образованием газовой смеси, состоящей в основном из водорода (около 72%), углекислого газа (около 23%) и окиси углерода (около 2%>). Из реактора конвертированный влажный газ поступает на мембраны диффузионного отде-
|
Рис. 8.8. Принципиальная схема получения водорода конверсией метанола. |
лителя водорода 5, где происходит очистка водорода от примесей. Чистый водород потребляется в ЭХГ, а остаточный газ. не прошедший через мембраны отделителя, расходуется на отопление реактора.

 Опубликовано в
Опубликовано в